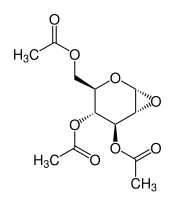
3,4,6-Tri-O-acetyl-1,2-anhydro-α-D-glucopyranose
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 3,4,6-Tri-O-acetyl-1,2-anhydro-α-D-glucopyranose | ||||||||||||
| Andere Namen |
Brigl-Anhydrid | ||||||||||||
| Summenformel | C12H16O8 | ||||||||||||
| Kurzbeschreibung |
weiße, schiefwinklige Tafeln[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 288,25 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
| ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
3,4,6-Tri-O-acetyl-1,2-anhydro-α-D-glucopyranose (Trivialname: Brigl-Anhydrid) ist eine chemische Verbindung, die sich von der Glucose ableitet. Sie ist als Zwischenprodukt in der organischen Synthese von Bedeutung. Der Trivialname ist insofern irreführend, dass hier kein klassisches Säureanhydrid vorliegt, sondern tatsächlich ein Epoxid (in der Zuckerchemie spricht man in diesem Zusammenhang ebenfalls von Anhydriden).
Geschichte
[Bearbeiten | Quelltext bearbeiten]Das Brigl-Anhydrid ist nach Percy Brigl benannt, der es erstmals 1922 synthetisierte. Seine Synthese ging von dem Edukt Pentaacetyl-β-D-glucose aus, welche er in einem ersten Schritt durch Erhitzen mit einem Überschuss an Phosphorpentachlorid zu 3,4,6-Tri-O-acetyl-2-trichloracetyl-D-glucopyranosylchlorid umsetzte. Im zweiten Schritt wurde die Trichloracetylgruppe durch Rühren in eiskaltem etherischem Ammoniak in Form von Trichloracetamid abgespalten. Das so erhaltene 3,4,6-Tri-O-acetyl-D-glucopyranosylchlorid wurde im letzten einer Ammoniak-vermittelten Eliminierung von Chlorwasserstoff unterzogen. Diese letzte Reaktion zog sich über mehrere Stunden hin. Über das Verhältnis der α- und β-Formen der chlorhaltigen Zwischenprodukte ist nichts Näheres bekannt.[1]

Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die neueste Synthesevorschrift basiert auf der direkten Oxidation von 3,4,6-Tri-O-acetyl-D-glucal. Als Oxidationsmittel wird 2,6-Dichlorpyridin-N-oxid[3] verwendet; die Reaktion wird mit einem Ruthenium-Porphyrin-Komplex katalysiert. Das Produkt entsteht dabei mit 67 % Ausbeute und einem Diastereomerenverhältnis α:β von 10:1.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das Brigl-Anhydrid reagiert mit Nucleophilen unter Öffnung des Epoxids. Dabei findet zunächst Walden-Umkehr statt; es werden also grundsätzlich β-Formen erzeugt. Brigl fand allerdings die Ausnahme von Wasser als Nucleophil: Hierbei wurde 3,4,6-Tri-O-acetyl-α-D-glucose[5] gebildet. Er ging davon aus, dass dies aber ein Produkt einer der Synthese nachgelagerten Epimerisierung sein muss. Eine weitere Additionsreaktion ist mit Acetanhydrid möglich, wobei sich neben anderen Produkten hauptsächlich Pentaacetyl-α-D-glucose.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g P. Brigl: Kohlenhydrate II. Über ein neues, das 1, 2-Anhydrid der Glucose. In: Hoppe-Seyler's Zeitschrift für physiologische Chemie. Band 122, Nr. 6, 1922, S. 245–262, doi:10.1515/bchm2.1922.122.4-6.245.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,6-Dichlorpyridin-N-oxid: CAS-Nr.: 2587-00-0, EG-Nr.: 679-082-0, ECHA-InfoCard: 100.204.082, PubChem: 817673, ChemSpider: 714340, Wikidata: Q82134897.
- ↑ J.-L. Zhang, C.-M. Che: Soluble polymer-supported ruthenium porphyrin catalysts for epoxidation, cyclopropanation, and aziridination of alkenes. In: Organic Letters. Band 4, Nr. 11, 2002, S. 1911–1914, doi:10.1021/ol0259138.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3,4,6-Tri-O-acetyl-α-D-glucopyranose: CAS-Nr.: 99396-10-8, PubChem: 14077893, ChemSpider: 74053290, Wikidata: Q113470600.