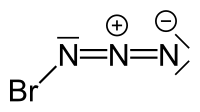
Bromazid
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Bromazid | ||||||||||||
| Summenformel | BrN3 | ||||||||||||
| Kurzbeschreibung |
farblose explosive Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 121,92 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
löslich in Wasser[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Bromazid ist eine chemische Verbindung aus der Gruppe der Azide bzw. der Stickstoffhalogenide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Bromazid kann durch Reaktion von Brom mit Natriumazid oder Stickstoffwasserstoffsäure oder Silberazid gewonnen werden.[5][6][2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bromazid ist eine farblose explosive Flüssigkeit.[1] Die Kondensation von gasförmigem Bromazid zu einer dann orangeroten Flüssigkeit führt meist zur Explosion.[7] Die reine Flüssigkeit zersetzt sich leicht und ist in Wasser löslich unter Bildung einer braunen Lösung.[3][8]
Das Bromazid-Molekül liegt in einer trans-Konfiguration vor mit schwach gewinkelter N3-Einheit und einem mit einer sp2-Hybridisierung am Br-tragenden N-Atom übereinstimmenden Br-N-N-Winkel.[5] Im Unterschied zum kettenförmigen Iodazid nimmt Bromazid eine helicale Festkörperstruktur ein.[9]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Bromazid liefert mit Alkenen vicinale Azido-brom-alkane. So liefert die Addition an Styrol in polaren Lösungsmitteln 1-Azido-2-brom-1-phenylethan mit 95 % Ausbeute.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Egon Wiberg: Lehrbuch der anorganischen Chemie. Walter de Gruyter GmbH & Co KG, 2019, ISBN 978-3-11-151030-9, S. 233 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b P. B. Saxena: Chemistry of Interhalogen Compounds. Discovery Publishing House, 2007, ISBN 978-81-8356-243-0, S. 96 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Kurt Dehnicke, Peter Ruschke: Die Ultraviolettspektren der Halogenazide ClN3, BrN3 und IN3 / The Ultraviolet Spectra of the Halogen Azides ClN3, BrN3 and IN3. In: Zeitschrift für Naturforschung B. 33, 1978, S. 750–752, doi:10.1515/znb-1978-0713.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Magdolna Hargittai, Inis C. Tornieporth-Oetting u. a.: Bromazid - Bestimmung der Molekülstruktur durch Elektronenbeugung in der Gasphase. In: Angewandte Chemie. 105, 1993, S. 773–774, doi:10.1002/ange.19931050529.
- ↑ a b R. Andree, Karl-Heinz Büchel, Karlheinz Doser, Luise Ellinghaus, A. Engel: Houben-Weyl Methods of Organic Chemistry Vol. E 16a, 4th Edition Supplement Organic N Compounds I. Georg Thieme Verlag, 2014, ISBN 978-3-13-181904-8, S. 1251 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Grundlagen und Hauptgruppenelemente. Walter de Gruyter GmbH & Co KG, 2016, ISBN 978-3-11-049340-5 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Advanced Inorganic Chemistry Vol-1. 1. Auflage. 1975, ISBN 81-87224-03-7, S. 746 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Benjamin Lyhs, Dieter Bläser u. a.: Festkörperstruktur von Bromazid. In: Angewandte Chemie. 124, 2012, S. 2008–2013, doi:10.1002/ange.201108092.

