Carotinoide

Als Carotinoide, auch Karotinoide,[1] wird eine umfangreiche Klasse natürlich vorkommender fettlöslicher Pigmente (Lipochrome) bezeichnet, denen chemisch als Grundgerüst ein Tetraterpen gemeinsam ist.
Ihr System von konjugierten Doppelbindungen absorbiert Licht kurzer Wellenlängen und verleiht je nach Anzahl, Lage und Seitenkette im Carotinoid diesem einen gelblichen bis rötlichen Farbton. Die mittlerweile über 800 bekannten Carotinoide werden in die Carotine und die sauerstoffhaltigen Xanthophylle unterschieden. Carotinoide gehören zu den Isoprenoiden.[2]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]| Carotinoid (E-Nummer) | Vorkommen |
|---|---|
| Astaxanthin (war E 161j) | Garnele, Hummer, Lachs |
| β-Carotin (E 160a[4]) | Möhre, Spinat, Aprikose, Einkorn |
| Canthaxanthin (E 161g[5]) | Garnele, Hummer, Pfifferling |
| Capsanthin (E 160c[6]) | Paprika |
| Capsorubin (E 160c[6]) | Paprika |
| Cryptoxanthin | Orange |
| Lutein (E 161b[7]) | Grünkohl, Spinat, Eidotter |
| Luteoxanthin | Orange |
| Lycopin (E 160d[8]) | Tomate, Wassermelone |
| Zeaxanthin (war E 161h) | Mais |
Carotinoide kommen zunächst in salzliebenden Archaeen (Halobakterien), in Bakterien, in den Chromoplasten und Plastiden von Pflanzen und in manchen Pilzen vor. Diese Organismen sind in der Lage, Tetraterpene de novo zu synthetisieren. Weiterhin treten sie in verschiedenen Tieren auf, die mit ihrer Nahrung farbstoffhaltiges Pflanzenmaterial aufnehmen. So finden sich Carotinoide dann in Schneckenhäusern, Muschelschalen oder Panzern sowie auch in Federn und Eigelb von Vögel oder beim Menschen in Haut und Netzhaut. Abgesehen von einzelnen Ausnahmen wie manchen Arten von Blattläusen[9] und Spinnmilben[10] besitzen tierische Organismen keine Gene für eine Carotinoid-Synthese.
Einige Carotinoide sind in der EU zugelassen als Lebensmittelzusatzstoffe; sie tragen die E-Nummern E 160a bis E 160g und E 161a bis E 161h.[11] Manche dienen der farblichen Gestaltung von Produkten.
Struktur
[Bearbeiten | Quelltext bearbeiten]


Typische Carotinoide haben die Grundstruktur von Tetraterpenen, aus acht Isopreneinheiten aufgebaute Verbindungen, und enthalten somit 40 C-Atome. Die ungesättigten Kohlenwasserstoffketten können an einem Ende oder beiden cyclisiert sein (Ionon-Ringe) oder nicht, wie beim Lycopin mit der Summenformel C40H56. Abwandlungen bestehen daneben in De-/Hydrierungen und den verschiedenen Arten von Oxidationsprodukten. Carotinoide werden unterteilt in die beiden Hauptgruppen
- Carotine, die ausschließlich aus Kohlenstoff und Wasserstoff aufgebaut sind,
- Xanthophylle, die sauerstoffhaltigen Derivate von Carotinen
Die Maxima der Absorptionsspektren von Carotinoiden liegen meist bei Wellenlängen um 400 bis 500 Nanometer.
Bedeutung als Provitamin A
[Bearbeiten | Quelltext bearbeiten]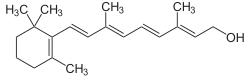
Tiere und Menschen sind nicht zur De-novo-Synthese von Vitamin A fähig und müssen daher ihren Bedarf über die Nahrung decken. Während Fleischfresser Vitamin A überwiegend in Form von Retinylestern oder Retinol aufnehmen, nutzen Pflanzenfresser bestimmte Carotinoide als Vorstufe. Von etwa 50 Carotinoiden ist eine Provitamin-A-Aktivität bekannt, sie können im biologischen Körper zu Vitamin A umgewandelt werden. Von diesen hat β-Carotin die größte Aktivität.[12]
Physiologie beim Menschen
[Bearbeiten | Quelltext bearbeiten]Der Mensch kann zur Vitamin-A-Bedarfsdeckung sowohl Retinol und Retinylester als auch Provitamin A nutzen. Die Aktivität von Nahrungscarotinoiden als Provitamin A drückt man mit Hilfe sogenannter Retinoläquivalente aus, wobei etwa 6 mg β-Carotin und 12 mg gemischte Carotinoide einem Retinoläquivalent entsprechen. Den Carotinoiden wird auch sonst große gesundheitliche Bedeutung zugesprochen. Im menschlichen Körper spielen sechs Carotinoide eine wesentliche Rolle: β-Carotin, α-Carotin, Lycopin, β-Cryptoxanthin, Lutein und Zeaxanthin. Die meisten von ihnen haben die Funktion von Antioxidantien. Dadurch sollen sie vielen Erkrankungen wie Krebs, Arteriosklerose, Rheuma, Alzheimer und Parkinson, Grauem Star oder der Hautalterung vorbeugen.
Von allen Nahrungscarotinoiden hat Lycopin (z. B. in Tomaten) das größte antioxidative Potenzial und gilt als wirksamster Schutz vor dem besonders reaktiven Singulett-Sauerstoff. Lycopin hemmt auch das Wachstum von Tumorzellen effektiver als α- oder β-Carotin.
Die antikanzerogene Wirkung der Carotinoide ergibt sich theoretisch auch aus ihrer Eigenschaft, eine gut funktionierende Kommunikation zwischen den Zellen herstellen zu können. Insbesondere β-Carotin, Cryptoxanthin und Canthaxanthin, regen den Austausch zwischen den Zellen an, indem sie die Synthese von Connexin bewirken. Diese Verbindung ist maßgeblich an der Bildung der Gap Junctions beteiligt, deren Anzahl bei Krebszellen vermindert ist. Carotinoide sollen jedoch nur in der Prävention eingesetzt werden, da sie in der eigentlichen Krebstherapie oder in der Vorbeugung gegen Rückfälle keine Wirkung zeigen. Besonders bei bereits an Krebs erkrankten Patienten sei mit hochdosierten Präparaten Vorsicht geboten.
In Leber, Augen, Haut und Fettgewebe liegen bestimmte Carotinoide in deutlich höherer Konzentration vor als in anderen Körpergeweben. In der Netzhaut des Auges, im sogenannten gelben Fleck (Macula), kommen die Carotinoide Lutein und Zeaxanthin in größeren Mengen vor. Diese Carotinoide wirken hier vermutlich als natürliche Schutzmechanismen, da die Netzhaut mit ihren besonders oxidationsempfindlichen mehrfach ungesättigten Fettsäuren besonders anfällig für den Angriff von freien Radikalen ist.
Für Carotinoide gilt, wie für andere sekundäre Pflanzenstoffe, dass sie nicht in Form von isolierten, hochkonzentrierten Präparaten aufgenommen werden sollten, sondern im natürlichen Verbund mit anderen Nahrungsinhaltsstoffen. Die Einnahme hochdosierter Präparate birgt sogar Gefahren. Eine regelrechte Vergiftung mit Carotinoiden ist zwar nicht möglich, β-Carotin-Supplemente können aber möglicherweise das Krebsrisiko erhöhen.[3]
Carotinoide als Farbstoffe in der Natur
[Bearbeiten | Quelltext bearbeiten]


Vögel
[Bearbeiten | Quelltext bearbeiten]Neben Melaninen spielen bei Vögeln für die Gefiederfärbung auch verschiedene Carotinoide eine Rolle. Mit der Nahrung aufgenommen, metabolisch abgewandelt und in die wachsenden Federn eingelagert, können sie zu gelblichen bis rötlichen Farbtönen führen. Auffälligere Beispiele für carotinoidgefärbtes Gefieder unter den Singvögeln sind die Blaumeise (Cyanistes caeruleus), die Kohlmeise (Parus major), die Schafstelze (Motacilla flava), der Pirol (Oriolus oriolus) oder der Buntspecht. Die rote Brust des Rotkehlchens (Erithacus rubecula) dagegen wird durch rotbräunliches Phäomelanin verursacht. Bei Gänsevögeln sind Carotinoide als Federpigmente selten und bisher nur bei der (wahrscheinlich ausgestorbenen) Rosenkopfente und der australischen Rosenohrente spektroskopisch nachgewiesen.[13] Wenn die Nahrung zu wenig oder keine Carotinoide enthält, sind die entsprechenden Federbereiche nach der nächsten Mauser weiß. Mutationen, die zu Störungen der Carotinoidanreicherung in der Feder führen, sind selten, solche mit veränderter Melanineinlagerung häufiger.[14]
Fische, Amphibien und Reptilien
[Bearbeiten | Quelltext bearbeiten]Bei Fischen, Amphibien und Reptilien entsteht die Farbe von Haut und Schuppen dadurch, dass Licht mit drei verschiedenen Typen von Chromatophoren (Pigmentzellen, Farbstoffbildende Zellen) interagiert, den Melanophoren, Xanthophoren und Iridophoren. Die Xanthophoren enthalten neben Pteridinen und Flavinen auch aus der Nahrung aufgenommene Carotine. Diese drei Farbstofftypen sind für gelbliche oder rote Farben verantwortlich.[15][16][17]
Dinoflagellaten und Bakterien
[Bearbeiten | Quelltext bearbeiten]


Bei den Dinoflagellaten, den einzelligen Algen, die im Süß- und Salzwasser vorkommen und zum Phytoplankton gehören, trägt Peridinin zur Pigmentierung bei. Dieses Carotinoid – ein Apocarotinoid mit der Summenformel C39H50O7 – bildet gemeinsam mit Chlorophyll a im Verhältnis von 4:1 an ein Proteingerüst gebunden einen Lichtsammelkomplex. Der Komplex fängt Photonen ein, überträgt deren Energie auf das zentrale Chlorophyllatom und macht sie so für eine Photosynthese nutzbar.[18] In nährstoffreichen Gewässern kann durch starke Vermehrung der Dinoflagellaten eine toxische Algenblüte hervorgerufen werden, auch Rote Flut (englisch red tide) genannt, deren Färbung vornehmlich am Peridinin liegt.[19] Andere photosynthetisch wichtige Carotinoide sind das Fucoxanthin (C42H58O6) und weitere Derivate, die als akzessorische Pigmente mitwirken.[20]
In den Zellmembranen von Bakterien kommen verschiedene Carotinoide glykosyliert oder nichtglykosyliert vor und schützen sie vor photooxidativer Zerstörung durch UV-Licht oder freie Radikale. Bei dem marinen Bakterium Micrococcus luteus ist beispielsweise das gelbliche Carotinoid Sarcinaxanthin vertreten, ein glykosyliertes zyklisches C50-Xanthophyll (C50H72O2).[21] Das sehr ähnliche gelbe Carotinoid Decaprenoxanthin (C50H72O2) kommt neben dem Sarcinaxanthin in Corynebakterien vor (z. B. Corynebacterium glutamicum, C. callunae, C. marinum).[22][23] Bei Staphylococcus aureus kommt die gelborangene Färbung durch Staphyloxanthin (C51H78O8) zustande, das neben der Stabilisierung der Membran durch seine antioxidative Wirkung auch zur Pathogenität dieses Erregers beiträgt.[24][25]
Funktion bei der Photosynthese
[Bearbeiten | Quelltext bearbeiten]Die primäre Aufgabe der Carotinoide bei der pflanzlichen Photosynthese ist es, Chlorophyllmoleküle vor Zerstörung durch Photooxidation zu schützen. Dabei fungieren sie als photoprotektive Agenzien, die die Pflanzenzelle durch nonphotochemisches Quenching vor reaktiven Sauerstoffspezies schützen. Außerdem erweitern sie das Absorptionsspektrum der photosynthetischen Organismen im blau-grünen Spektralbereich und sind teilweise auch am Energietransfer innerhalb der Antennenkomplexe und Photosysteme beteiligt. Dort arbeiten sie als Lichterntepigmente im Lichtsammelkomplex, die Photonen absorbieren und die Energie ans photosynthetische Reaktionszentrum weiterleiten. Man bezeichnet sie deshalb zusammen mit den Phycobilinen als akzessorische Pigmente der Photosynthese. Im Xanthophyllzyklus, der in den Chloroplasten stattfindet, wird überschüssige Lichtstrahlung absorbiert und in unschädliche Wärme umgewandelt.
Schätzungen über die jährliche Carotinoidsynthese durch Pflanzen belaufen sich auf 100 Millionen Tonnen im Jahr.
Die Zuteilung der Carotinoide zu den sekundären Pflanzenstoffen ist somit nicht ganz korrekt, da ihnen, entgegen der Definition der sekundären Pflanzenmetaboliten, klare primäre Funktionen in der Photosynthese zugeordnet werden können.
Technische Bedeutung und Synthese
[Bearbeiten | Quelltext bearbeiten]Von den ca. 700 bekannten natürlichen Carotinoiden besitzen einige eine größere technische Bedeutung und werden im industriellen Maßstab synthetisiert: β-Carotin, Astaxanthin, Canthaxanthin, 8'-Apo-β-carotinsäureethylester, 8'-Apo-β-carotinaldehyd, Citranaxanthin, Lycopin und Zeaxanthin.[26] Die technische Herstellung der naturidentischen Carotinoide wurde zuerst bei der Hoffmann-La Roche AG und bei der BASF SE entwickelt. Die Verfahren sind komplex und beinhalten als universelle Verknüpfungsmethoden:
- Wittig-Reaktion
- Horner-Wadsworth-Emmons-Reaktion
- Sulfonverknüpfung nach Julia
- Enoletherkondensation
- Saucy-Marbet-Umlagerungen.
Da häufig (E,Z)-Isomerengemische entstehen, schließt sich oft eine photochemische Isomerisierung (Umwandlung) der meist unerwünschten (Z)-Form in die gewünschte (E)-Form an.[27]
Biotechnologische Herstellung
[Bearbeiten | Quelltext bearbeiten]Es ist möglich, Gene zur Biosynthese von Carotinoiden in Pilze, Bakterien und Pflanzen einzubringen oder den Gehalt geschwindigkeitsbestimmender Enzymen zu erhöhen, um die Carotinoidproduktion zu steigern. Der Hefepilz Phaffia rhodozyma kann so genetisch verändert werden, dass er mehr Astaxanthin und auch artfremde Carotinoide herstellt. Ebenso ist es möglich, die Anreicherung von Zeaxanthin in Kartoffelknollen deutlich zu steigern.[28] Speziell für Entwicklungsländer wurde die transgene Reissorte mit dem Spitznamen Goldener Reis entwickelt, um der Vitamin-A-Unterversorgung entgegenzuwirken.
Verwendung als Farbstoff
[Bearbeiten | Quelltext bearbeiten]
Carotinoide werden häufig als Futtermittelzusatzstoff zugesetzt, um beispielsweise die Farbe des Fleisches beim Zuchtlachs zu beeinflussen, das bei Fütterung mit Fischmehlbrocken in Gefangenschaft ohne Zusatz grau wäre. Wildlachse nehmen den Farbstoff normalerweise durch Verzehr kleiner Krustentiere auf. Auch diese stellen ihn nicht selbst her, sondern fressen kleine Algen, die das Xanthophyll Astaxanthin enthalten.[29] In Kosmetikprodukten werden sie in der Liste der Inhaltsstoffe als CAROTENOIDS (INCI)[30] angegeben.

Aus ähnlichem Grund werden Flamingos im Zoo zusätzlich mit Carotinoiden gefüttert, denn sie können dort keine carotinoidhaltigen Krebse und Algen aufnehmen und verlören sonst ihre Gefiederfärbung. Ebenfalls kann die Färbung des Eidotters durch Zusätze im Futtermittel für Hühner beeinflusst werden, insbesondere, wenn die Tiere kaum Gräser oder Mais finden, die natürliche Carotinoide enthalten. Lebensmittel, die direkt mit Carotinoiden eingefärbt werden, sind zum Beispiel Margarine und Fruchtsäfte.[31]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ duden.de: Karotinoid, chemisch fachsprachlich Carotinoid.
- ↑ Zdzislaw Z. E. Sikorski: Chemical and Functional Properties of Food Lipids. CRC Press, 2010, ISBN 978-1-420-03199-7, S. 41.
- ↑ a b UGB: Carotinoide: Rot und gelb halten fit
- ↑ Eintrag zu E 160a: Carotenes in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 8. Januar 2022.
- ↑ Eintrag zu E 161g: Canthaxanthin in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 8. Januar 2022.
- ↑ a b Eintrag zu E 160c: Paprika extract, capsanthin, capsorubin in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 8. Januar 2022.
- ↑ Eintrag zu E 161b: Lutein in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 8. Januar 2022.
- ↑ Eintrag zu E 160d: Lycopene in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 8. Januar 2022.
- ↑ N. Moran, T. Jarvik: Lateral transfer of genes from fungi underlies carotenoid production in aphids. In: Science. Band 328. Jahrgang, 2010, S. 624–627, doi:10.1126/science.1187113, PMID 20431015.
- ↑ B. Altincicek, J. Kovacs, N. Gerardo: Horizontally transferred fungal carotenoid genes in the two-spotted spider mite Tetranychus urticae. In: Biology Letters. Band 8. Jahrgang, Nr. 2, 2012, S. 253–257, doi:10.1098/rsbl.2011.0704, PMID 21920958, PMC 3297373 (freier Volltext).
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Xanthophylle im Lexikon der Ernährung, abgerufen am 7. März 2009
- ↑ Thomas Arnhold: 1.4.1 Vitamin-A-Quellen In: Untersuchungen zum Metabolismus von Vitamin A / Retinoiden im Hinblick auf eine Risikoabschätzung ihrer teratogenen Wirkung beim Menschen; S. 6–7; Dissertation; Braunschweig, 7. März 2000. Volltext
- ↑ Daniel B. Thomas, Helen F. James: Non-destructive Raman spectroscopy confirms carotenoid-pigmented plumage in the Pink-headed Duck In: Volume 133, 2016, S. 147–154 doi:10.1642/AUK-15-152.1 pdf (Seite dauerhaft nicht mehr abrufbar, festgestellt im Dezember 2023. Suche in Webarchiven)
- ↑ Hein van Grouw: Not every white bird is an albino: sense and nonsense about colour aberrations in birds. Dutch Birding, Vol. 28, no. 2, 2006 S. 79–89 (PDF; 458 kB).
- ↑ Tony Gamble, Jodi L. Aherns, Virginia Card: Tyrosinase Activity in the Skin of Three Strains of Albino Gecko (Eublepharis macularius). ( vom 27. Januar 2012 im Internet Archive) Gekko 5: S. 39–44. (PDF; 767 kB).
- ↑ J. Odenthal, K. Rossnagel, P. Haffter, R. N. Kelsh, E. Vogelsang, M. Brand, F. J. van Eeden, M. Furutani-Seiki, M. Granato, M. Hammerschmidt, C. P. Heisenberg, Y. J. Jiang, D. A. Kane, M. C. Mullins, C. Nüsslein-Volhard: Mutations affecting xanthophore pigmentation in the zebrafish, Danio rerio. In: Development Band 123, Dezember 1996, S. 391–398, PMID 9007257.
- ↑ Frost-Mason SK, Mason KA: What insights into vertebrate pigmentation has the axolotl model system provided?, In: The International Journal of Developmental Biology, Band 40, Nr. 4, August 1996, S. 685–693, PMID 8877441.
- ↑ D. Carbonera, M. Di Valentin, R. Spezia, A. Mezzetti: The Unique Photophysical Properties of the Peridinin-Chlorophyll-a-Protein. In: Current Protein Peptid Science, Band 15, Nr. 4, Juni 2014, S. 332–350; doi:10.2174/1389203715666140327111139, PMID 24678668, PMC 4030626 (freier Volltext).
- ↑ N. Furuichi, H. Hara, T. Osaki, M. Nakano, H. Mori, S. Katsumura: Stereocontrolled total synthesis of a polyfunctional carotenoid, peridinin. In: Journal of Organic Chemistry, Band 69, Nr. 23, 12. November 2004, S. 7949–7959, doi:10.1021/jo048852v, PMID 15527275.
- ↑ T. Polívka, R. Hiller, D. Zigmantas, V. Sundström: Excited state dynamics of the carotenoid peridinin. In: Femtochemistry and Femtobiology, Dezember 2004, S. 445–452, doi:10.1016/B978-044451656-5/50087-6.
- ↑ R. Netzer, M. Stafsnes, T. Andreassen, A. Goksøyr, P. Bruheim, T. Brautaset: Biosynthetic pathway for γ-cyclic sarcinaxanthin in Micrococcus luteus: heterologous expression and evidence for diverse and multiple catalytic functions of C(50) carotenoid cyclases. In: Journal of Bacteriology. Band 192, Nr. 21, November 2010, S. 5688–5699, doi:10.1128/JB.00724-10, PMID 20802040, PMC 2953688 (freier Volltext).
- ↑ S. Heider, P. Peters-Wendisch, V. Wendisch: Carotenoid biosynthesis and overproduction in Corynebacterium glutamicum. In: BMC Microbiology Band 12, Nr. 198, 10. September 2012, doi:10.1186/1471-2180-12-198.
- ↑ N. Henke, S. Heider, S. Hannibal, V. Wendisch, P. Peters-Wendisch: Isoprenoid Pyrophosphate-Dependent Transcriptional Regulation of Carotenogenesis in Corynebacterium glutamicum. In: Microbiology Band 24, 8. April 2017, S. 633, doi:10.3389/fmicb.2017.00633.
- ↑ A. Popov, A. Kapreliants, D. Ostrovskiĭ, V. Ignatov: Study of the membranes of pigment-free mutant of Staphylococcus aureus. In: Biokhimiia Band 41, Nr. 6, Juli 1976, S. 1116–1120, PMID 1027489.
- ↑ C. Liu, G. Liu, Y. Song, F. Yin, M. Hensler, W. Jeng, V. Nizet, A. Wang, E. Oldfield: A Cholesterol Biosynthesis Inhibitor Blocks Staphylococcus aureus Virulence. In: Science, Band 319, Nr. 5868, März 2008, S. 1391–1394, doi:10.1126/science.1153018, PMC 2747771 (freier Volltext).
- ↑ Bernd Schäfer: Naturstoffe der chemischen Industrie, Elsevier GmbH, Spektrum Verlag, 2007, S. 407–434, ISBN 978-3-8274-1614-8.
- ↑ Karl Meyer: Carotinoide – Bedeutung und technische Synthesen: Farbenfrohe Antioxidantien. In: Chemie in unserer Zeit. Band 36, Nr. 3, 2002, S. 178–192.
- ↑ Goethe-Universität Frankfurt am Main, Institut für Molekulare Biowissenschaften AK Sandmann: Carotinoid Biosynthese in Pflanzen und Mikroorganismen ( vom 24. Juni 2009 im Internet Archive).
- ↑ farbimpulse.de - Wie die Farbe in den (Zucht-)Lachs kommt ( vom 24. Juni 2009 im Internet Archive), 24. September 2008.
- ↑ Eintrag zu CAROTENOIDS in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. März 2022.
- ↑ Barbara Reye: Wie mehr Farbe auf den Teller und in den Zoo kommt, 10. Februar 2009.