Cashmeran
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
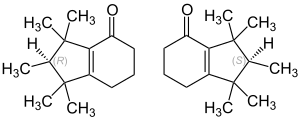
| ||||||||||||||||
| 1:1-Gemisch aus der (R)-Form (links) und der (S)-Form (rechts) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cashmeran | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C14H22O | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 206,32 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
0,969 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
256 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
112 mg·l−1 in Wasser (23 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Cashmeran ist ein synthetischer Duftstoff aus der Gruppe der Cyclohexenone. Es wird als Racemat oft Reinigungsprodukten als geruchsgebende Komponente zugesetzt.[4]
Name
[Bearbeiten | Quelltext bearbeiten]Die Bezeichnung wurde in Bezug auf Eigenschaften von Kaschmirwolle gewählt. Cashmeran verleiht Parfums eine weiche, seidige Note. Cashmeran ist der von International Flavors & Fragrances vergebene Handelsname für den Duftstoff. Der chemische Name lautet 6,7-Dihydro-1,1,2,3,3-pentamethyl-4(5H)-indanon. Die Abkürzung – DPMI – wird in verschiedenen Publikationen synonym verwendet.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Cashmeran wurde von International Flavors and Fragrances in den 1970er-Jahren von John Hall[5] entdeckt. Zu der Erfindung von Cashmeran kam es aufgrund von Forschungen nach kostengünstigen Verfahren zur chemischen Transformation von Stoffen mit Pentamethylindan- und Tetramethylnaphthalen-Strukturen. In diesem Zusammenhang wurde Cashmeran, ein ungesättigtes Keton, als ein wichtiger neuer Duftstoff identifiziert.
Physikalische und chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Cashmeran ist ein alicyclisches Keton. Bei Raumtemperatur erscheint es als weißer Feststoff, sein Schmelzpunkt liegt bei 27 °C. Als Siedepunkt wurde eine Temperatur von 256 °C berichtet, jedoch hat man in einigen Tests eine Zersetzung des Materials bei 220 °C festgestellt.[2]
Geruch
[Bearbeiten | Quelltext bearbeiten]Obwohl Cashmeran von einigen Seiten als polycyclische Moschusverbindung beschrieben wurde, ist es weder primär ein Moschusduftstoff, noch gehört es zur Gruppe der polycyclischen Moschusverbindungen. Die International Fragrance Association (IFRA) definiert polycyclische Moschusverbindungen als Verbindungen, die:
- primär und einzig aufgrund ihres Moschusdufts verwendet werden
- eine Summenformel von C17H24O oder C18H26O haben, und einen zentralen aromatischen Benzolring enthalten
Obwohl Cashmeran holzig-moschusartige Duftnoten hat, ist sein Geruch komplex, geprägt von würzigen, fruchtigen, balsamischen, chypre- und vanilleartigen Duftnoten. Cashmeran findet aufgrund seines eigenen charakteristischen Geruchs Verwendung, dieser unterscheidet sich grundlegend von üblichen Moschusverbindungen. Dies spiegelt sich auch in seiner typischen Verwendungsmenge von circa 2 Prozent wider,[6] im Vergleich dazu liegt zum Beispiel die Verwendungsmenge der polycyclischen Moschusverbindung HHCB (Galaxolid) in Düften bei bis zu 30 Prozent. Cashmeran fehlt zudem auch der aromatische Benzolring, den polycyclische Moschusverbindungen enthalten.
Umweltdaten
[Bearbeiten | Quelltext bearbeiten]Cashmeran hat einen Biokonzentrationsfaktor (BCF) von 157 für Cyprinus carpio und einen Octanol-Wasser-Verteilungskoeffizienten (log KOW) von 4,2 bei 20 °C. Aus dem BCF folgt, dass diese Verbindung nicht besonders bioakkumulierbar ist.[2]
Die kurzfristige aquatische Toxizität für Cashmeran liegt bei >1 mg/L für aquatische Spezies (Daphnien, Algen und Fische). Cashmeran hat eine Umweltgefährlichkeitseinstufung H411 gemäß EU CLP.
In diesem Sinne sind die Biokonzentration und aquatische Toxizität von Cashmeran bei den in der Umwelt gefundenen Konzentrationen eher unkritisch. Mehrere Studien zur Überwachung[7][8][9][10][11][12][13][14][15] wurden in verschiedenen Umweltbereichen und Menschen durchgeführt. Einige Studien haben Spuren von DPMI nachgewiesen, die gefundenen Werte lagen bei unter 1 ppm, üblicherweise sogar unter 1 ppb.
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Cashmeran ist hautreizend (H315) und verursacht schwere Augenreizungen (H319). Es kann allergische Reaktionen verursachen und sensibilisierend wirken (H317). Cashmeran ist als gesundheitsgefährdend eingestuft.[2][16][17][18]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu DIHYDRO PENTAMETHYLINDANONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. Januar 2022.
- ↑ a b c d e f g h i Registrierungsdossier zu 1,2,3,5,6,7-hexahydro-1,1,2,3,3-pentamethyl-4H-inden-4-one bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 24. November 2014.
- ↑ a b Eintrag zu 1,2,3,5,6,7-Hexahydro-1,1,2,3,3-pentamethyl-4H-inden-4-on in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Oktober 2021. (JavaScript erforderlich)
- ↑ L. Wang, S. J. Kahn: Enantioselective analysis and fate of polycyclic musks in a water recycling plant in Sydney (Australia), Water Science and Technology (2014), 69(10) S. 1996–2003, doi:10.2166/wst.2014.095.
- ↑ Patent US3773836: INDANONE DERIVATIVES AND PROCESSES FOR PRODUCING SAME. Veröffentlicht am 20. November 1973, Erfinder: J. Hall.
- ↑ Synthetics Compendium ( vom 11. September 2014 im Internet Archive). (PDF, 6,8 MB).
- ↑ Eschke H.-D., Dibowski H.-J. and Traud J. Studies on the occurrence of polycyclic musk flavors in different environmental compartments. Second communication: Findings in surface waters, waste waters, and fish as well as in detergents and cosmetics. Umweltwiss. Schadst.-Forsch. Z. Umweltchem Okotox., 7(3), 131–138.
- ↑ Eschke H.-D., Dibowski H.-J. and Traud J. Detection and quantitative analysis of musk fragrances by means of ion-trap GC/MS/MS in human fat and breast milk. Deutsche Lebensmittel-Rundschau, 91(12), 375–379.
- ↑ Zehringer M. and Herrmann A. Analysis of polychlorinated biphenyls, pyrethroid insecticides and fragrances in human milk using a laminar cup liner in the GC injector. European Food Research and Technology, 212(2), 247–251.
- ↑ Hutter H.-P., Wallner P., Moshammer H., Hartl W., Sattelberger R., Lorbeer G. and Kundi M. Blood concentrations of polycyclic musks in healthy young adults. Chemosphere, 59(4), 487–492.
- ↑ Ricking M., Schwarzbauer J., Hellou J., Svenson A. and Zitko V. Polycyclic aromatic musk compounds in sewage treatment plant effluents of Canada and Sweden–first results. Marine Pollution Bulletin, 46(4), 410–417.
- ↑ Zhang S., DiFrancesco, A., Chiu, P., Allen, H. and Salvito, D. Removal mechanisms for fragrance materials in sludge-amended soils. American Chemical Society 228th National Meeting, Philadelphia, PA. 25 August 2004.
- ↑ Heberer Th., Jurgensen S., Fromme H. Synthetic musks in theaquatic system of Berlin as an example for urban ecosystems. In: Rimkus GH (ed.), Synthetic Musk Fragrances in the Environment. The Handbook of Environmental Chemistry. Springer Verlag, Berlin, Germany, S. 123–150.
- ↑ Schlumpf, M., Kypke, K., Wittassek, M., Angerer, J., Mascher, H., Mascher, D., Vokt, C., Birchler, M., and Lichtensteiger, W. Exposure patterns of UV filters, fragrances, parabens, phthalates, organochlor pesticides, PBDEs, and PCBs in human milk: Correlation of UV filters with use of cosmetics. Chemosphere 81, 1171–1183.
- ↑ Guo R., Lee I., Kim U., Oh J. Occurrence of synthetic musks in Korean sewage sludges. Science of the Total Environment 408, 1634–1639.
- ↑ Kevekordes S., Mersch-Sundermann V., Diez M. and Dunkelberg H. In vitro genotoxicity of polycyclic musk fragrances in the micronucleus test. Mutation Research, 395(2–3), 145–150.
- ↑ Kevekordes S., Mersch-Sundermann V., Diez M., Bolten C. and Dunkelberg H. Genotoxicity of polycyclic musk fragrances in the sister-chromatid exchange test. Anticancer Research, 18(1A), 449–452.
- ↑ Mersch-Sundermann V., Kevekordes S. and Jenter C. Lack of mutagenicity of polycyclic musk fragrances in Salmonella typhimurium. Toxicology in Vitro, 12(4), 389–393.

