Cefiderocol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
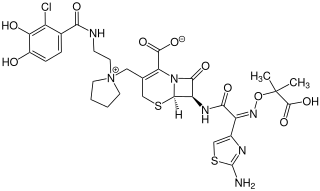
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Cefiderocol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C30H34ClN7O10S2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 752,21 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Cefiderocol ist ein Antibiotikum aus der Gruppe der Cephalosporine.
Indikationen
[Bearbeiten | Quelltext bearbeiten]Cefiderocol wurde 2019 in den USA unter dem Handelsnamen Fetroja (Shionogi) zugelassen[2] zur parenteralen Behandlung komplizierter Harnwegsinfektionen, wenn andere Behandlungsmöglichkeiten begrenzt sind.
Die Zulassung von Cefiderocol in den USA beinhaltet die Behandlung von komplizierten, durch bestimmte gramnegative Bakterien verursachte, Harnwegsinfektionen inklusive der Pyelonephritis bei Patienten ab 18 Jahren. Die Anwendung erfolgt durch intravenöse Injektion und soll dann zum Einsatz kommen, wenn von einer bakteriellen Erkrankungsursache auszugehen ist und andere Behandlungsmöglichkeiten eingeschränkt sind, um der Entwicklung von Antibiotikaresistenzen entgegenzuwirken.[3]
Im April 2020 folgte in der EU die Zulassung unter dem Namen Fetcroja zur Therapie von durch aerobe gramnegative Organismen verursachten Infektionen bei Erwachsenen.[4]
Als häufigste unerwünschte Wirkungen wurden Durchfall, Reaktionen an der Infusionsstelle, Verstopfung, Hautausschlag, Candidiasis, Husten , Erhöhung der Leberwerte, Kopfschmerzen, erniedrigte Kaliumspiegel sowie Übelkeit und Erbrechen beobachtet.[5]
Wirkungsprinzip
[Bearbeiten | Quelltext bearbeiten]Das β-Lactam-Molekül enthält einen Siderophor genannten Strukturteil, über die es sich an Eisen(III)-Ionen zu binden vermag.[6] Dadurch kann es über ein aktives Fe3+-Transportsystem der bakteriellen Zellwand in die gramnegative Bakterienzelle hinein gelangen, auch in solche von multiresistenten Stämmen. Darüber hinaus gelangt Cefiderocol durch passive Diffusion in die Bakterienzelle. Es ist stabil gegenüber β-Lactamasen aller bekannten Klassen. Die antibiotische Wirkung entsteht über die Hemmung der Biosynthese von Peptidoglykanen, die wichtige Bestandteile der bakteriellen Zellwand sind.[7]
Cefiderocol besitzt ein breites antimikrobielles Spektrum in vitro gegen gramnegative Erreger,[7] darunter auch gegen solche, denen die Weltgesundheitsorganisation erste Priorität für die Entwicklung neuer Therapieoptionen einräumt (Carbapenem-resistente Stämme von Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacteriaceae[8]). Gegen grampositive und anaerobe Bakterien ist es wenig aktiv.
Die weltweite Zunahme Carbapenem-resistenter gramnegativer Bakterien wird von einigen Wissenschaftlern als Bedrohung für die öffentliche Gesundheit gesehen. Bakterien mit dieser Resistenzausprägung können nicht nur nahezu alle β-Lactam-Antibiotika abbauen und somit unwirksam machen, sondern sind wegen des häufigen gleichzeitigen Erwerbs von Nicht-β-Lactam-Resistenzgenen oft auch gegen andere Behandlungsoptionen resistent. Neuartige Therapieoptionen spielen daher bei der Behandlung von Infektionen durch solche Keime eine besondere Rolle.[9][6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Pharmazeutisch-chemische Beschreibung
[Bearbeiten | Quelltext bearbeiten]Pharmazeutisch verwendet wird der Wirkstoff als Cefiderocolsulfattosilat-Hydrat,[S 1][S 2] also als kristallwasserhaltiges Salz der Schwefelsäure und Toluolsulfonsäure.[5]
Strukturell ähnelt Cefiderocol den Cephalosporinen Ceftazidim und Cefepim, weswegen es wie diese der Hydrolyse durch β-Lactamasen standhalten kann. Eine Besonderheit ist die Addition einer Catecholeinheit an die Seitenkette am C-3, die Eisen cheliert und natürlich vorkommende Siderophore nachahmt.[6]
Pharmakokinetische Daten
[Bearbeiten | Quelltext bearbeiten]- Plasmaproteinbindung: 40–60 %
- Eliminationshalbwertszeit: 2–3 Stunden
- Scheinbares Verteilungsvolumen: 18 Liter
- Metabolisierung: unter 10 %
- Eliminationsweg: renal (98,6 %, davon zu 90,6 % unverändert), über die Fäzes (2,8 %)[5]
Trivia
[Bearbeiten | Quelltext bearbeiten]Cefiderocol wird von Mikroorganismen über einen aktiven Prozess in die Zelle geschleust, da Cefiderocol eine strukturelle Ähnlichkeit mit den bakteriellen Siderophoren hat. Aufgrund dieser aktiven Aufnahme des Antibiotikums in die Bakterienzelle wird Cefiderocol mitunter als „trojanisches Pferd“ bezeichnet.[10] Der Hersteller trug dem Wirkmechanismus im Handelsnamen Fetroja und der Gestaltung der Umverpackung, die ein stilisiertes Pferd zeigt, Rechnung.[11]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Ambeed: Cefiderocol, abgerufen am 24. Januar 2020.
- ↑ Novel Drug Approvals for 2019. FDA (englisch).
- ↑ Drugs@FDA: FDA Approved Drug Products. FDA (englisch).
- ↑ Summary of opinion: Fetcroja. CHMP, 27. Februar 2020 (PDF), abgerufen am 3. März 2020.
- ↑ a b c Prescribing Information ‚Fertoja‘, Stand November 2019 (PDF).
- ↑ a b c T. Sato, K. Yamawaki: Cefiderocol: Discovery, Chemistry, and In Vivo Profiles of a Novel Siderophore Cephalosporin. In: Clinical Infectious Diseases. Band 69, Supplement 7. November 2019, S. S538–S543, doi:10.1093/cid/ciz826, PMID 31724047, PMC 6853759 (freier Volltext).
- ↑ a b B. Gensthaler: Neues Antibiotikum gegen gramnegative Bakterien, Pharmazeutische Zeitung, 28. Februar 2020.
- ↑ Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics, WHO, Februar 2017. (englisch)
- ↑ T. Tängdén, C. G. Giske: Global dissemination of extensively drug-resistant carbapenemase-producing Enterobacteriaceae: clinical perspectives on detection, treatment and infection control. Journal of Internal Medicine, Band 277 (2015), S. 501-12.T, doi:10.1111/joim.12342
- ↑ Robert A Bonomo: Cefiderocol: A Novel Siderophore Cephalosporin Defeating Carbapenem-resistant Pathogens. In: Clinical Infectious Diseases. Band 69, Supplement_7, 13. November 2019, S. S519–S520, doi:10.1093/cid/ciz823, PMID 31724046, PMC 6853757 (freier Volltext).
- ↑ Celine Müller, Apothekerin, Redakteurin DAZ.online (cel): Cefiderocol: Antibiotikum als trojanisches Pferd. 11. März 2020, abgerufen am 28. Januar 2022.
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Cefiderocolsulfattosilat (3:1:4), wasserfrei: CAS-Nr.: 2009350-94-9, PubChem: 131801106, Wikidata: Q89910616. Molare Masse: 3043,50 g·mol−1; UNII: 2V3QJ9TGE5
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Cefiderocolsulfattosilat-Hydrat: CAS-Nr.: 2135543-94-9, PubChem: 131839616, DrugBank: DBSALT002912, Wikidata: Q89909615. UNII: TTP8LBP45D; Formel: 3 C30H34ClN7O10S2 · 4 C7H8O3S · H2SO4 · x H2O.