Chlorsubstituierte Benzole
| Chlorsubstituierte Benzole | |||
| Benzol C6H6 |
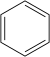
| ||
| 6 °C[1] | |||
| 80 °C[1] | |||
| Chlorbenzol C6H5Cl |

| ||
| −45 °C[2] | |||
| 132 °C[2] | |||
| Dichlorbenzole C6H4Cl2 |
 |
 |
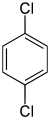
|
| o- | m- | p- | |
| −18 °C[3] | −22 °C[4] | 53 °C[5] | |
| 179 °C[3] | 173 °C[4] | 174 °C[5] | |
| Trichlorbenzole C6H3Cl3 |
 |
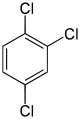 |

|
| 1,2,3- | 1,2,4- | 1,3,5- | |
| 53 °C[6] | 17 °C[7] | 63 °C[8] | |
| 221 °C[6] | 213 °C[7] | 209 °C[8] | |
| Tetrachlorbenzole C6H2Cl4 |
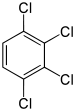 |
 |

|
| 1,2,3,4- | 1,2,3,5- | 1,2,4,5- | |
| 47 °C[9] | 54,5 °C[10] | 139,5 °C[11] | |
| 246 °C[9] | 246 °C[10] | 244,5 °C[11] | |
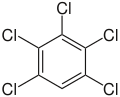
| Pentachlorbenzol C6HCl5 |
| ||
| 84–87 °C[12] | |||
| 275–277 °C[12] | |||
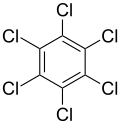
| Hexachlorbenzol C6Cl6 |
| ||
| 231 °C[13] | |||
| 323–326 °C[13] | |||
Die chlorsubstituierten Benzole leiten sich vom Benzol ab, bei dem ein oder mehrere Wasserstoffatome durch ein Chloratom ersetzt werden. Auf diese Weise ergeben sich 12 verschiedene Verbindungen, die sich in Substitutionsgrad und Symmetrie voneinander unterscheiden. Diese Eigenschaften spielen hier die wesentliche Rolle und werden im Vergleich dargestellt.
Man unterscheidet nach der Anzahl der Chloratome und deren Position am Ring in:
- (Mono-)Chlorbenzol C6H5Cl
- Dichlorbenzole C6H4Cl2, drei Strukturisomere (1,2-Dichlorbenzol, 1,3-Dichlorbenzol, 1,4-Dichlorbenzol)
- Trichlorbenzole C6H3Cl3, drei Strukturisomere (1,2,3-Trichlorbenzol, 1,2,4-Trichlorbenzol, 1,3,5-Trichlorbenzol)
- Tetrachlorbenzole C6H2Cl4, drei Strukturisomere (1,2,3,4-Tetrachlorbenzol, 1,2,3,5-Tetrachlorbenzol, 1,2,4,5-Tetrachlorbenzol)
- Pentachlorbenzol C6HCl5
- Hexachlorbenzol C6Cl6
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Siedepunkte
[Bearbeiten | Quelltext bearbeiten]Insgesamt erhöhen sich die Siedepunkte im Schnitt mit jedem hinzutretenden Chlorsubstituenten – im Gegensatz zu den methylsubstituierten Benzolen eher uneinheitlicher – um etwa 30–50 °C (80[1] – 132[2] – ⌀ 175 – ⌀ 211 – ⌀ 246 – 275[12] – 323[13]). Die Siedepunkte der jeweiligen drei Isomere bei den Di-, Tri- und Tetrachlorbenzolen liegen nah beieinander und unterscheiden sich innerhalb einer Gruppe um maximal 12 °C. Die Symmetrie spielt hier praktisch keine Rolle.
Schmelzpunkte
[Bearbeiten | Quelltext bearbeiten]Bei den Schmelzpunkten kommt vor allem die Symmetrie zum Tragen. Zunächst ist ausgehend von Benzol zu Chlorbenzol ein deutliches Absinken des Schmelzpunktes um etwa 50 °C von +6 auf −45 °C festzustellen – durch das Einführen eines einzigen Chlorsubstituenten in das hochsymmetrische Benzolmolekül.
Bei den Di-, Tri- und Tetrachlorbenzolen sind das p-Dichlorbenzol (C 2), das 1,3,5-Trichlorbenzol (C 3) und das 1,2,4,5-Tetrachlorbenzol (C 2) die Vertreter mit der jeweils höchsten Symmetrie.
- Dichlorbenzole: Das p-Dichlorbenzol, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt von 53 °C. Es ist im Gegensatz zu den anderen beiden Isomeren ein Feststoff.
- Trichlorbenzole: Die Schmelzpunkte erscheinen im Vergleich zu den Dichlorbenzolen eher uneinheitlich. Das 1,3,5-Trichlorbenzol ist in dieser Gruppe der höchstsymmetrische Vertreter, der Schmelzpunkt beträgt 63 °C.
- Tetrachlorbenzole: Das 1,2,4,5-Tetrachlorbenzol besitzt aufgrund seiner Symmetrie den höchsten Schmelzpunkt bei 139,5 °C.
- Pentachlorbenzol schmilzt bei 84–87 °C. Im Vergleich mit den Tetrachlorbenzolen ist dieser aufgrund der niedrigeren Symmetrie tiefer als der von 1,2,4,5-Tetrachlorbenzol mit 139,5 °C. Er liegt aber auch aufgrund des höheren Substitutionsgrades höher als der von 1,2,3,4-Tetrachlorbenzol mit 47 °C und 1,2,3,5-Tetrachlorbenzol mit 54,5 °C.
- Hexachlorbenzol besitzt mit 231 °C den mit Abstand höchsten Schmelzpunkt der chlorsubstituierten Benzole.
Dichte
[Bearbeiten | Quelltext bearbeiten]Die Dichte nimmt vom Benzol ausgehend zu (0,88[1] – 1,11[2] – ⌀ 1,29 – ⌀ 1,67 – ⌀ 1,80 – 1,61[12] – 2,05[13]), zeigt aber beim Pentachlorbenzol eine Ausnahme mit einem niedrigeren Wert.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu Benzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Chlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu o-Dichlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu m-Dichlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu p-Dichlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu 1,2,3-Trichlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu 1,2,4-Trichlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu 1,3,5-Trichlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu 1,2,3,4-Tetrachlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu 1,2,3,5-Tetrachlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu 1,2,4,5-Tetrachlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Pentachlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Hexachlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Dezember 2019. (JavaScript erforderlich)
Literatur
[Bearbeiten | Quelltext bearbeiten]- Beyer / Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 445–446.