Zimtaldehyd
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Strukturformel von trans-Zimtaldehyd | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Zimtaldehyd | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C9H8O | |||||||||||||||||||||
| Kurzbeschreibung |
gelbliche, intensiv nach Zimt riechende, ölige Flüssigkeit[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 132,16 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,05 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
246–253 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex |
1,6219 (20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Zimtaldehyd (3-Phenyl-2-propenal) ist eine gelbliche, intensiv nach Zimt riechende, ölige Flüssigkeit. Er ist der Hauptaromastoff der Zimtrinde und wurde erstmals im Jahre 1834 aus Zimtöl isoliert. Zimtaldehyd ist eine organische chemische Verbindung mit der Summenformel C9H8O und zählt zur Stoffgruppe der Phenylpropanoide. Er gehört zu den Aromaten und ist ein α,β-ungesättigter Aldehyd.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Zimtaldehyd wurde 1834 von Jean-Baptiste Dumas und Eugène-Melchior Péligot aus Zimtöl isoliert und 1856 von Luigi Chiozza synthetisiert.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Zimtaldehyd kommt natürlich im Zimtrindenöl (42–68 %) und Cassiaöl (bis 90 %) vor, in geringerem Maße aber auch in den Blättern des Zimtbaums und in vielen anderen ätherischen Ölen.[5][6] So kann Zimtaldehyd auch in Sellerie, Benediktenkraut, Commiphora myrrha, Feigen, Gartenhyazinthen, Lavendel (Lavandula sp), Tomaten, Äpfeln, Myrtenheiden, Balsambäumen (Myroxylon balsamum), Piment, Anis, Indischem Patschuli, Rosa damascena, Heidelbeeren, Gewürzvanille, Weinreben, dem Gewürznelkenbaum und dem Tamarindenbaum nachgewiesen werden.[7]
-
Borke des Zimtbaums (Cinnamomum verum)
-
Rinde des Zimtbaums (Cinnamomum verum)
-
Sellerie
-
Äpfel
-
Zimtaldehyd in einem Glas
Isomerie
[Bearbeiten | Quelltext bearbeiten]Die Kohlenstoff-Kohlenstoff-Doppelbindung in der Seitenkette des Zimtaldehyds ist typischerweise trans-konfiguriert. Der isomere cis-Zimtaldehyd [Synonym: (Z)-Zimtaldehyd] hat nur eine geringe Bedeutung. Die Angaben in diesem Artikel beziehen sich nur auf den trans-Zimtaldehyd [Synonym: (E)-Zimtaldehyd].
| Isomere von Zimtaldehyd | ||
| Name | trans-Zimtaldehyd | cis-Zimtaldehyd |
| Andere Namen | (E)-Zimtaldehyd | (Z)-Zimtaldehyd |
| Strukturformel |  |

|
| CAS-Nummer | 14371-10-9 | 57194-69-1 |
| 104-55-2 (unspez.) | ||
| EG-Nummer | 604-377-8 | – |
| 203-213-9 (unspez.) | ||
| ECHA-Infocard | 100.111.079 | – |
| 100.002.922 (unspez.) | ||
| PubChem | 637511 | 6428995 |
| 307 (unspez.) | ||
| Wikidata | Q204036 | Q27161918 |
| Q60041699 (unspez.) | ||
Darstellung
[Bearbeiten | Quelltext bearbeiten]Natürliche Quellen
[Bearbeiten | Quelltext bearbeiten]Zimtaldehyd wird durch Wasserdampfdestillation aus der Rinde (in geringerer Qualität auch den Blättern) des Zimtbaums gewonnen.[5] Aus der Rinde des Zimtbaums (Cinnamomum verum) wird Zimtöl gewonnen, das zu 65–75 % aus Zimtaldehyd besteht.[8]
Technische Synthesen
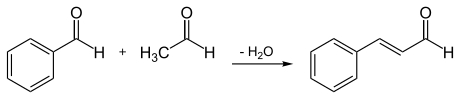
[Bearbeiten | Quelltext bearbeiten]trans-Zimtaldehyd kann analog zur Zimtsäure mittels Aldol-Kondensation aus Benzaldehyd und Acetaldehyd in 60%iger Ausbeute dargestellt werden.[9]
Die Darstellung gelingt auch durch Vilsmeier-Formylierung von Styrol in 30%iger Ausbeute.[10]

Der cis-Zimtaldehyd kann durch eine photochemische Isomerisierung aus der trans-Verbindung erhalten werden:[3]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
(blau =negative, rot = positive Ausgleichsladung)
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Zimtaldehyd ist eine gelbliche, intensiv nach Zimt riechende, ölige Flüssigkeit, die an der Luft allmählich zu Zimtsäure oxidiert.[2] Er schmilzt bei −8 °C und siedet bei 251 °C bei Normaldruck.[2] Er löst sich sehr schlecht in Wasser (1,1 g/l bei 20 °C),[2] hingegen ist er mischbar mit Ethanol, Diethylether und Chloroform.[3]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Zimtaldehyd ist gegen Licht, Wärme, Alkalien und einige Metalle empfindlich und zeigt die üblichen Aldehyd- und Olefinreaktionen.[6]
Durch Meerwein-Ponndorf-Verley-Reduktion kann er zu Zimtalkohol in 75%iger Ausbeute reduziert werden.[11]

Durch Autoxidation an der Luft entsteht Zimtsäure.
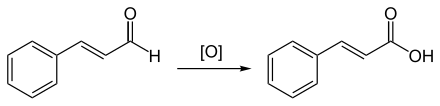
Durch stärkere Oxidationsmittel wie Kaliumpermanganat oder Ozon wird Zimtaldehyd zu Benzoesäure oxidiert.

Durch Hydrierung der Doppelbindung entsteht der Hydrozimtaldehyd.[12]

Strukturelle Verwandte
[Bearbeiten | Quelltext bearbeiten]
Ein Derivat ist der Coniferylaldehyd [3-(4-Hydroxy-3-methoxyphenyl)-2-propenal], der am Benzolring zusätzlich an der 4-Position eine Hydroxy- und an der 3-Position eine Methoxygruppe trägt, und damit das Substitutionsmuster wie beim Vanillin aufweist.
 |
 |
|
| Zimtalkohol | Zimtaldehyd | Zimtsäure |
Verwendung
[Bearbeiten | Quelltext bearbeiten]Zimtaldehyd wird als Riechstoff in der Parfümherstellung bei der Komposition orientalischer Parfüms benutzt.[13] Es dient auch als Duftstoff in Kosmetika, z. B. in Lippenstiften, Wasch-, Reinigungsmittel, Zahnpasta und Mundwasser. Ebenso findet es als Gewürz in Nahrungsmitteln Verwendung.[5]
In reiner Form hat er sensibilisierende Eigenschaften und kann zu allergischen Hautreaktionen führen.[4] Patienten mit einer Zimtaldehydallergie reagieren häufig auch auf Perubalsam, was auf Kreuzallergien hindeutet. Die Verbindung reagiert mit nukleophilen Strukturbestandteilen von Proteinen, vor allem den Thiolgruppen des Cysteins, und kann dadurch eine Immunreaktion vom Spättyp auslösen.[5] Aufgrund seines hohen allergenen Potentials ist er ein Bestandteil des sogenannten „Duftstoff-Mix“ (engl. fragrance mix) für Epikutantests.[14][15]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu 2-Propenal, 3-phenyl-. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 10. September 2013.
- Riechstoff-Lexikon: Zimtaldehyd
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu FEMA 2286 in der Datenbank der Flavor and Extract Manufacturers Association of the United States.
- ↑ a b c d e f g h i j k l Eintrag zu Zimtaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- ↑ a b c Eintrag zu Zimtaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. April 2014.
- ↑ a b Datenblatt trans-Zimtaldehyd bei Merck, abgerufen am 10. September 2013.
- ↑ a b c d Ausschuss für Gefahrstoffe: Begründung zu Zimtaldehyd in TRGS 907 - Ausgabe: Dezember 2011 – Stand: Mai 2011.
- ↑ a b Dieter Martinetz, Roland Hartwig: Taschenbuch der Riechstoffe: ein Lexikon von A-Z. Harri Deutsch Verlag, 1998, ISBN 3-8171-1539-3, S. 404 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ CINNAMALDEHYDE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 25. Juli 2023.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 978-3-906390-29-1, S. 313.
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 470.
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 345.
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 505.
- ↑ Patent US3372199A: Process for the production of hydrocinnamaldehyde. Angemeldet am 20. März 1964, veröffentlicht am 5. März 1968, Anmelder: Engelhard Corporation, Erfinder: Nathan Himselstein, Paul N. Rylander.
- ↑ Juliane Daphi-Weber, Heike Raddatz, Rainer Müller: Untersuchung von Riechstoffen – Kontrollierte Düfte, S. 94–95, in Band V der Reihe HighChem hautnah – Aktuelles aus der Lebensmittelchemie (Herausgegeben von der Gesellschaft Deutscher Chemiker) 2010, ISBN 978-3-936028-64-5.
- ↑ Jean-Marie Lachapelle: Patch Testing and Prick Testing. Springer Science & Business Media, 2012, ISBN 978-3-642-25492-5, S. 108 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Axel Trautmann: Allergiediagnose Allergietherapie. Thieme, 2006, ISBN 978-3-13-169061-6 (eingeschränkte Vorschau in der Google-Buchsuche).





