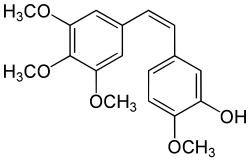
Combretastatin A-4
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Combretastatin A-4 | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C18H20O5 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 316,35 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Combretastatin A-4 ist ein Naturstoff aus der Gruppe der Stilbene. Erstmals entdeckt und isoliert wurde es aus Combretum caffrum, einer Art von südafrikanischen Langfäden.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Natürliche Combretastatine kommen im afrikanischen Baum Combretum caffrum vor.[2] Pflanzen synthetisieren Combretastatin und andere Stilbene als Abwehrstoffe über den Shikimisäureweg über Phenylalanin und Malonyl-CoA. Der letzte Schritt der Biosynthese wird durch das Enzym Stilbensynthase katalysiert.[3] Chemisch gesehen handelt es sich um Stilbenoide, da sich die Strukturen von Stilben (1,2‑Diphenylethen) ableiten. Es gibt mehrere natürlich vorkommende Derivate, der bekannteste und biologisch aktivste Vertreter ist das Combretastatin A-4. Für pharmazeutische Formulierungen ist die geringe Wasserlöslichkeit von 350 µM[4] ein Nachteil.
Wirkung
[Bearbeiten | Quelltext bearbeiten]Combretastatin A-4 ist ähnlich wie das Alkaloid Colchicin ein Inhibitor der Tubulin-Polymerisation, das Mikrotubuli destabilisiert und in eine Tasche zwischen der α- und β-Untereinheit von Tubulin bindet.[5] Diese Tasche wird daher in der Literatur als „colchicine binding site“ bezeichnet. Derzeit (2019) befindet sich Fosbretabulin, ein Phosphorsäureester von Combretastatin A-4, aufgrund seiner Antitumor-Aktivität in einer Phase II klinischen Studie.[6] In Laborversuchen konnte auch eine Wirkung von Combretastatin A-4 gegen Dengue- und Zika-Viren gezeigt werden.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Combretastatin A4, ≥98% (HPLC), powder bei Sigma-Aldrich, abgerufen am 11. Dezember 2019 (PDF).
- ↑ G. R. Pettit, S. B. Singh, E. Hamel, C. M. Lin, D. S. Alberts: Isolation and structure of the strong cell growth and tubulin inhibitor combretastatin A-4. In: Experientia. Band 45, Nr. 2, Februar 1989, S. 209–211, doi:10.1007/BF01954881.
- ↑ Philippe Jeandet, Bertrand Delaunois, Alexandra Conreux, David Donnez, Vitale Nuzzo: Biosynthesis, metabolism, molecular engineering, and biological functions of stilbene phytoalexins in plants. In: BioFactors. Band 36, Nr. 5, 2010, S. 331–341, doi:10.1002/biof.108.
- ↑ Lauren Lee, Lyda M. Robb, Megan Lee, Ryan Davis, Hilary Mackay: Design, Synthesis, and Biological Evaluations of 2,5-Diaryl-2,3-dihydro-1,3,4-oxadiazoline Analogs of Combretastatin-A4. In: Journal of Medicinal Chemistry. Band 53, Nr. 1, 14. Januar 2010, S. 325–334, doi:10.1021/jm901268n, PMID 19894742, PMC 2810428 (freier Volltext).
- ↑ Roberto Gaspari, Andrea E. Prota, Katja Bargsten, Andrea Cavalli, Michel O. Steinmetz: Structural Basis of cis- and trans-Combretastatin Binding to Tubulin. In: Chem. Band 2, Nr. 1, 12. Januar 2017, S. 102–113, doi:10.1016/j.chempr.2016.12.005.
- ↑ Karol Jaroch, Maciej Karolak, Przemysław Górski, Alina Jaroch, Adrian Krajewski: Combretastatins: In vitro structure-activity relationship, mode of action and current clinical status. In: Pharmacological Reports. Band 68, Nr. 6, 1. Dezember 2016, S. 1266–1275, doi:10.1016/j.pharep.2016.08.007.
- ↑ Michael Richter, Mila M. Leuthold, Dominik Graf, Ralf Bartenschlager, Christian D. Klein: Prodrug Activation by a Viral Protease: Evaluating Combretastatin Peptide Hybrids To Selectively Target Infected Cells. In: ACS Medicinal Chemistry Letters. Band 10, Nr. 8, 8. August 2019, S. 1115–1121, doi:10.1021/acsmedchemlett.9b00058, PMID 31413794, PMC 6691480 (freier Volltext).

