Kresole
| Kresole | |||||
| Name | o-Kresol | m-Kresol | p-Kresol | ||
| Andere Namen | 2-Methylphenol 2-Hydroxytoluol |
3-Methylphenol 3-Hydroxytoluol |
4-Methylphenol 4-Hydroxytoluol | ||
| MIXED CRESOLS (INCI)[1] | |||||
| Strukturformel | 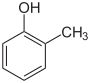
|

|
|||
| CAS-Nummer | 95-48-7 | 108-39-4 | 106-44-5 | ||
| 1319-77-3 (Isomerengemisch)[2] | |||||
| PubChem | 335 | 342 | 2879 | ||
| FL-Nummer | 04.027 | 04.026 | 04.028 | ||
| Summenformel | C7H8O | ||||
| Molare Masse | 108,14 g·mol−1 | ||||
| Aggregatzustand | fest | flüssig | fest | ||
| Kurzbeschreibung | farblose bis gelbliche Kristalle bzw. Flüssigkeit mit stechendem, teerartigen Geruch[3][4][5] | ||||
| Schmelzpunkt | 31 °C[3] | 10,9 °C[4] | 34,8 °C[5] | ||
| Siedepunkt | 191 °C[3] | 203 °C[4] | 202 °C[5] | ||
| pKs-Wert[6] | 10,28 | 10,09 | 10,26 | ||
| Dichte | 1,05 g·cm−3[3] | 1,03 g·cm−3[4] | 1,03 g·cm−3[5] | ||
| Löslichkeit | 25,0 g·l−1 (25 °C)[3] | 23,5 g·l−1 (20 °C)[4] | 20,0 g·l−1 (20 °C)[5] | ||
| GHS- Kennzeichnung |
| ||||
| H- und P-Sätze | 301‐311‐314 | ||||
| keine EUH-Sätze | |||||
| 201‐280‐301+310+330‐303+361+353‐304+340+310‐305+351+338[7] | |||||
| MAK | Schweiz: 5 ml·m−3 bzw. 22 mg·m−3[8] | ||||
Die Kresole (auch Hydroxytoluole bzw. Methylphenole) bilden in der Chemie eine Stoffgruppe aromatischer Verbindungen, die sich sowohl vom Phenol als auch vom Toluol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Hydroxy- (–OH) und Methylgruppe (–CH3) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C7H8O. In erster Linie sind sie als methylsubstituierte Phenole anzusehen. Ferner spricht man bei den halogenierten Derivaten ebenfalls von Kresolen.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Kresole und deren Derivate (z. B. Xylenole) sind in der Natur weit verbreitet. Man findet sie als Metaboliten in verschiedenen Mikroorganismen sowie im Urin von Säugetieren, im Steinkohlen- und Buchenholzteer.

Alle drei Kresole kommen in Tee, Arabica-Kaffee, Gemüsespargel, Besen-Beifuß, Japanischem Liguster und der Weißen Maulbeere vor.[9][10][11] o-Kresol findet sich außerdem in Estragon, Spanischem Pfeffer, Ölpalmen, Echtem Süßholz, Tomaten, Polei-Minze, Pfefferminze, Indischem Patschuli, Sauerkirschen, dem Sandelholzbaum, Gelben Schlauchpflanzen und Scutellaria baicalensis.[9] m-Kresol kommt natürlich auch in Commiphora myrrha, Tabak und Rheum palmatum vor.[10] p-Kresol kann zudem in der Süße Akazie, Estragon, Rooibos, Ylang-Ylang, Spanischem Pfeffer, Meerträubel (Ephedra sinica), Stech-Wacholder, Polei-Minze, Pfefferminze, Anis, Sauerkirschen, Rheum palmatum, Himbeeren, dem Sandelholzbaum, Baikal-Helmkraut, dem Tamarindenbaum, Amerikanischen Heidelbeeren, Heidelbeeren, Gewürzvanille und Tahiti-Vanille nachgewiesen werden.[11]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Ursprünglich wurden die nicht derivatisierten Kresole aus Steinkohlen- und Buchenholzteer isoliert. Man erhält ein flüssiges, gelbbraunes Isomerengemisch, das so genannte Trikresol. Einmalige Destillation führt zur rohen Carbolsäure. Die Reinherstellung der drei Kresole erfolgt auf Grundlage von Carbolöl durch Extraktion mit Natronlauge. Alternativ wird das Phenoraffin-Verfahren durchgeführt, bei dem zur Extraktion eine Natriumphenolat-Lösung und Diisopropylether eingesetzt werden.
Synthetisch können Kresole durch Verkochung des jeweiligen Diazoniumsalzes der Toluidine dargestellt werden.
Großtechnisch wird Kresol, unter anderem durch die Reaktion von Chlortoluol mit Natronlauge unter hohen Temperaturen (~250 °C) und Druck (~300 bar) in einem Rohrreaktor synthetisiert.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Kresole sind stark licht- und luftempfindlich. Bei Temperaturen oberhalb von 80 °C bilden sich mit Luft explosionsfähige Gemische. Sie sind in Wasser wenig löslich und verbrennen unter starker Rußentwicklung. Kresole haben einen teerartigen Geruch. Mit Propen reagiert m-Kresol zu Thymol.
pKs-Wert
[Bearbeiten | Quelltext bearbeiten]Die Methylgruppe übt einen (schwachen) +I-Effekt auf den Aromaten aus, wodurch die Elektronendichte im Ring erhöht wird. Dadurch wird u. a. die Acidität des phenolischen OH abgeschwächt. Die pKs-Werte sind daher etwas höher als die des Phenols (9,99[6]).
Reaktivität
[Bearbeiten | Quelltext bearbeiten]Neben dem (schwachen) +I-Effekt der Methylgruppe ist jedoch der +M-Effekt der Hydroxygruppe entscheidender für die chemische Reaktivität. Beide Effekte erhöhen deutlich die Elektronendichte im Ring. Der −I-Effekt der Hydroxygruppe hat nur sehr wenig Einfluss auf die Eigenschaften der Kresole. Die Kresole gehen daher relativ leicht elektrophile aromatische Substitutionen ein.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Kresole wirken als Bakterizid, Insektizid und Fungizid. Sie sind deshalb vielfach Bestandteil von Desinfektionsmitteln. m-Kresol findet als Fungizid in der Landwirtschaft Anwendung. 8 µl/g genügen, um Getreide 60 Tage lang bei einer Lagertemperatur von 30 °C frei von Pilzbefall zu halten. m-Kresol ist als pharmazeutischer Hilfsstoff beispielsweise Bestandteil von Insulin glargin. Die typischen Konzentrationen liegen im Bereich von 1,5 bis 3 mg pro ml Injektionslösung.[12][13]
Kresole werden auch verwendet, um daraus Kunst- und Farbstoffe, Kunstharze (Kresolharze) und Arzneimittel herzustellen.
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Kresol-Vergiftungen rufen recht unspezifische Symptome hervor. Anzeichen einer chronischen Vergiftung sind Kopfschmerzen, Husten- und Brechreiz, Appetitverlust sowie Mattheit und Schlaflosigkeit. Eine Aufnahme über die Haut durch Resorption erfolgt sehr schnell. Akute Vergiftungen mit Nierenschäden und Störungen des Zentralnervensystems wie Krämpfen, Bewusstlosigkeit und Atemlähmung können die Folge sein. Kresole gelten als karzinogen.
Wie bei Phenolen allgemein kommt es bei oraler Einnahme zu (weißlichen) Verätzungen, welche schmerzlos sind, da Phenole anästhetisch wirken. Vergiftungserscheinungen treten beim Menschen ab etwa 3 g auf, ab etwa 10 g besteht die Möglichkeit eines tödlichen Schocks.
Darüber hinaus wirken Phenole und insbesondere Kresole stark denaturierend auf Proteine. Da sie stark ätzend sind, rufen sie bei Hautkontakt akute Hautschäden hervor, zerstören das Eiweiß der Hautzellen und überwinden den Schutzmechanismus der Haut, welche leicht sauer ist, beinahe sofort. Bei Kontamination offener Schleimhäute (Mundhöhle, Nase, After) gelangen sie direkt ins Blut, wobei sie im Körper rasch verteilt werden und zu multiplen Eiweißschädigungen der inneren Organe führen. Ohne sofortige Einleitung von Gegenmaßnahmen können Kresole auch in geringer Menge lebensbedrohliche Wirkung haben.
Risikobewertung
[Bearbeiten | Quelltext bearbeiten]p-Kresol wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von p-Kresol waren die Besorgnisse bezüglich Verbraucherverwendung, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Stoffe und als potentieller endokriner Disruptor. Die Neubewertung fand ab 2015 statt und wurde vom Vereinigten Königreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[14][15]
Nachweis
[Bearbeiten | Quelltext bearbeiten]Kresole können schon in Konzentrationen von wenigen Mikrogramm pro Kubikmeter Luft geruchlich wahrgenommen werden.
Zur Messung von o-, m- und p-Kresol-Expositionen am Arbeitsplatz nach den Kriterien des Messsystems Gefährdungsermittlung der Unfallversicherungsträger (MGU) wird mithilfe einer geeigneten Pumpe ein definiertes Luftvolumen durch ein Silicagelröhrchen gesaugt, sodass die in der Luft enthaltenen Kresole vom Silicagel adsorbiert werden. Zur analytischen Bestimmung wird das Silicagel mit Diethylether extrahiert. Die qualitative und quantitative Bestimmung erfolgt gaschromatographisch mit einem Flammenionisationsdetektor. Die Bestimmungsgrenze beträgt 0,5 mg/m³ bei 40 L Probeluftvolumen.[16]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Klemm, Elias: Direktsynthese von Phenol und Kresol. Vom Katalysator zum Verfahren, Shaker Verlag GmbH 2002, ISBN 3-8265-9896-2.
- Autorenkollektiv: Organikum, 22. Auflage, Wiley-VCH, Weinheim, 2004, ISBN 3-527-31148-3.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- IR-Spektren der Kresole: o-Kresol; m-Kresol; p-Kresol
- Phenole und Kresole
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu MIXED CRESOLS in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- ↑ Eintrag zu Kresol, Isomere in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Mai 2017. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu o-Kresol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. September 2012. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu m-Kresol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. September 2012. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu p-Kresol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. September 2012. (JavaScript erforderlich)
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Datenblatt Cresol mixture of isomers bei Sigma-Aldrich, abgerufen am 8. Mai 2017 (PDF).
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 1319-77-3 bzw. Kresol (alle Isomeren)), abgerufen am 2. Januar 2025.
- ↑ a b O-CRESOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. Juli 2023.
- ↑ a b M-CRESOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. Juli 2023.
- ↑ a b P-CRESOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. Juli 2023.
- ↑ Werner Waldhäusl: Diabetes in der Praxis. Springer-Verlag, 2013, ISBN 978-3-642-97435-9, S. 406 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Peter Hürter: Diabetes bei Kindern und Jugendlichen. Springer-Verlag, 2013, ISBN 978-3-662-06575-4, S. 134 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): p-cresol, abgerufen am 20. Mai 2019.
- ↑ Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA): MEGA-Auswertungen zur Erstellung von REACH-Expositionsszenarien für Kresole. Abgerufen am 11. Juli 2023.


