Cyanameisensäureethylester
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
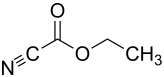
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cyanameisensäureethylester | ||||||||||||||||||
| Summenformel | C4H5NO2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 99,09 g·mol−1 | ||||||||||||||||||
| Dichte |
1,003 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Siedepunkt |
115–116 °C[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,381 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Cyanameisensäureethylester ist eine chemische Verbindung, die zu den Carbonsäureestern und Nitrilen zählt.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Cyanameisensäureethylester kann durch Reaktion von Ethylchloroformat mit Natriumcyanid hergestellt werden, wobei die Ausbeute jedoch gering ist. Alternativ kann Carbonyldicyanid mit Ethanol umgesetzt werden. Carbonyldicyanid muss jedoch zuerst aus Tetracyanoethylen hergestellt werden, indem dieses mit Wasserstoffperoxid zu Tetracyanothylenoxid epoxidiert wird und dieses mit Dibutylsulfid umgesetzt wird. Eine einfache Synthesemethode mit guter Ausbeute ist die Reaktion von Ethylchloroformat mit Kaliumcyanid in Dichlormethan in Gegenwart von [18]Krone-6.[3]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Die Reaktion mit Hydroxylaminen ergibt Nitron-Derivate, die weiter zu diversen Heterocyclen umgesetzt werden können, beispielsweise Imidazolen und Benzimidazolen.[4] Unter Katalyse mit einem N-heterocyclischen Carben können Aldehyde durch Reaktion mit Cyanameisensäureethylester in Kohlensäureester der entsprechenden Cyanhydrine überführt werden.[5] Während die Verbindung meist als Dipolarophil in der Heterocyclen-Synthese wirkt, kann es unter geeigneten Bedingungen auch als Überträger von Cyanogruppen oder Ethoxycarbonylgruppen wirken.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Ethyl cyanoformate, 99% bei Sigma-Aldrich, abgerufen am 2. Juni 2014 (PDF).
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-240.
- ↑ Michael E. Childs, William P. Weber: Preparation of cyanoformates. Crown ether phase transfer catalysis. In: The Journal of Organic Chemistry. Band 41, Nr. 21, Oktober 1976, S. 3486–3487, doi:10.1021/jo00883a041.
- ↑ Paula S. Branco, Sundaresan Prabhakar, Ana M. Lobo, David J. Williams: Reactions of hydroxylamines with ethyl cyanoformate. preparation of aminonitrones and their synthetic applications. In: Tetrahedron. Band 48, Nr. 30, Januar 1992, S. 6335–6360, doi:10.1016/S0040-4020(01)88224-7.
- ↑ Jie Zhang, GuangFen Du, YueKe Xu, Lin He, Bin Dai: N-heterocyclic carbene catalyzed cyanation reaction of carbonyl compounds with ethyl cyanoformate and acetyl cyanide. In: Tetrahedron Letters. Band 52, Nr. 52, Dezember 2011, S. 7153–7156, doi:10.1016/j.tetlet.2011.10.119.
- ↑ Anca‐Elena Dascălu, Elena Bîcu, Segiu Shova, Emmanuelle Lipka, Benoît Rigo, Muriel Billamboz, Alina Ghinet: Insights on the Chemical Behavior of Ethyl Cyanoformate: Dipolarophile, Cyano or Ethoxycarbonyl Source. In: ChemistrySelect. Band 4, Nr. 46, 13. Dezember 2019, S. 13724–13730, doi:10.1002/slct.201903114.


