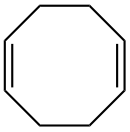
1,5-Cyclooctadien
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,5-Cyclooctadien | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H12 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit unangenehmem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 108,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,88 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
150 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (<500 mg·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,4905[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
1,5-Cyclooctadien (manchmal auch nur Cyclooctadien) ist eine organische Verbindung mit der Summenformel C8H12. Sie besteht aus einem achtgliedrigen Ring, welcher zweifach ungesättigt ist, und gehört als cyclisches Dien zu den Cycloalkenen. Die Doppelbindungen sind nicht konjugiert. 1,5-Cyclooctadien wird besonders in Komplexen als COD abgekürzt.
Darstellung
[Bearbeiten | Quelltext bearbeiten]1,5-Cyclooctadien kann durch Dimerisierung von 1,3-Butadien am Nickelkatalysator Bis-[cyclooctadien-(1,5)]-nickel(0) hergestellt werden. Die weltweite Jahresproduktion liegt bei etwa 10.000 Tonnen.[3]
Verbindungen und Reaktionen
[Bearbeiten | Quelltext bearbeiten]
Es kann als labiler zweizähniger Chelatligand in Übergangsmetallkomplexen verwendet werden. Hierbei bindet 1,5-Cyclooctadien über beide Doppelbindungen am Metallzentrum. COD kann leicht durch andere Liganden substituiert werden, weshalb COD-Komplexe als Edukte zur Komplexsynthese dienen können.
- Herstellung von Nickeltetracarbonyl aus Ni(COD)2 und Kohlenstoffmonoxid.
Ni(COD)2 kann durch Reduktion von Nickelacetylacetonat mit Triethylaluminium und COD hergestellt werden.[4]
Es ist eine Reihe niedervalenter Übergangsmetallkomplexe mit COD bekannt, eine größere Bedeutung besitzt hiervon der Crabtree-Katalysator.

9-BBN, das zur Hydroborierung eingesetzt wird, wird durch Addition von COD an ein Dimethylsulfidboran hergestellt.[5]

Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Eintrag zu 1,5-Cyclooctadien in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Thomas Schiffer, Georg Oenbrink: Cyclododecatriene, Cyclooctadiene, and 4-Vinylcyclohexene, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH, Weinheim 2005.
- ↑ R. Schunn, S. Ittel, Bis(1,5-Cyclooctadiene) Nickel(0), in: Inorg. Synth., 1990, 28, S. 94; doi:10.1002/9780470132593.ch25.
- ↑ John A. Soderquist, Alvin Negron: 9-Borabicyclo[3.3.1]nonane, dimer In: Organic Syntheses. 70, 1992, S. 169, doi:10.15227/orgsyn.070.0169; Coll. Vol. 9, 1998, S. 95 (PDF).





![{\displaystyle \mathrm {[Ni(C_{5}H_{7}O_{2})_{2}]_{3}\ +\ 6\ COD\ +\ 6\ Al(C_{2}H_{5})_{3}\rightarrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ff7438b2cf82a58a3bb7f5f1407dbaca3fa7b6a)
