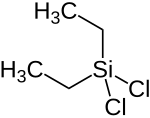
Dichlor(diethyl)silan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dichlor(diethyl)silan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H10Cl2Si | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 157,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
1,05 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
125–131 °C[1] | |||||||||||||||
| Löslichkeit |
zersetzt sich in Wasser[3] | |||||||||||||||
| Brechungsindex |
1,4309 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Dichlor(diethyl)silan ist eine chemische Verbindung aus der Gruppe der siliciumorganischen Verbindungen.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Dichlor(diethyl)silan wird gemeinsam mit Chlor(triethyl)silan und Trichlor(ethyl)silan über die Müller-Rochow-Synthese gebildet. Dabei reagiert gepulvertes Silicium mit Chlorethan in Gegenwart von gepulvertem Kupfer und Kupfer(II)-oxiden als Katalysator zu Dichlor(diethyl)silan:[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Dichlor(diethyl)silan ist eine farblose, feuchtigkeitsempfindliche Flüssigkeit.[2] Es zersetzt sich in Wasser.[3]
Bei der Kernspinresonanzspektroskopie von Dichlor(diethyl)silan werden folgende chemische Verschiebungen beobachtet:[5]
| Si–CH2– | –CH3 | |
|---|---|---|
| 1H | 1,10 | 1,10 |
| 13C | 12,2 | 6,1 |
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Der Dampf von Dichlor(diethyl)silan kann mit Luft ein explosionsfähiges Gemisch (Flammpunkt 26,1 °C, unter Explosionsgrenze: 1,13 Vol-%) bilden.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Durch Hydrierung von Dichlordiethylsilan mit Lithiumaluminiumhydrid oder Natriumhydrid kann Diethylsilan hergestellt werden:[6] [7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Dichlorodiethylsilane, 99% bei Sigma-Aldrich, abgerufen am 11. Mai 2015 (PDF).
- ↑ a b c David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-168.
- ↑ a b c d Eintrag zu Dichlordiethylsilan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ Didier Astruc: Organometallic Chemistry and Catalysis. Springer Science & Business Media, 2007, ISBN 978-3-540-46129-6, S. 329 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Manfred Hesse, Herbert Meier, Bernd Zeeh: Spektroskopische Methoden in der organischen Chemie. Georg Thieme Verlag, 2005, ISBN 978-3-135-76107-7, S. 224 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Didier Astruc: Organometallic Chemistry and Catalysis. Springer Science & Business Media, 2007, ISBN 978-3-540-46129-6, S. 257 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Stephan Pawlenko: Organosilicon Chemistry. Walter de Gruyter, 1986, ISBN 978-3-11-086238-6, S. 30 (eingeschränkte Vorschau in der Google-Buchsuche).



![{\displaystyle {\ce {Si{}+2ClC2H5->[\mathrm {Cu} ][](C2H5)2SiCl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cdb801ff0eba9a47024e252e67cf888878829de0)

