Dihydrolevoglucosenon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dihydrolevoglucosenon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H8O3 | |||||||||||||||
| Kurzbeschreibung |
klare farblose bis hellgelbe[1] Flüssigkeit | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 128,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
< −19,99 °C[1] bei 1,013 hPa | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
0,28 hPa bei 25 °C[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Dihydrolevoglucosenon ist ein bicyclisches, chirales, siebengliedriges heterocyclisches Cycloalkanon (Oxepanon), das als biobasiertes und vollständig bioabbaubares aprotisch-dipolares Lösungsmittel in vielen Anwendungen eine „grüne“ Alternative zu problematischen organischen Lösungsmitteln, wie z. B. Dimethylformamid (DMF), N-Methyl-2-pyrrolidon (NMP) oder Sulfolan bieten könnte.[4]
Darstellung
[Bearbeiten | Quelltext bearbeiten]Aus ligninfreier Cellulose, Lignocellulose bzw. cellulosehaltiger minderwertiger Biomasse wie Holzabfällen oder Sägemehl, kann der Celluloseanteil durch säurekatalysierte Pyrolyse[5] bei 300 °C über die Zwischenstufe Levoglucosan (LGA) in den ungesättigte Anhydrozucker Levoglucosenon (LGO) als Vorstufe von Dihydrolevoglucosenon (H2-LGO) gespalten werden. Die Ausbeuten an LGO betragen dabei etwas über 10 %; daneben entstehen erhebliche Mengen verkohlter bzw. teerartiger Rückstände, die als Brennstoffe verwendet werden können.
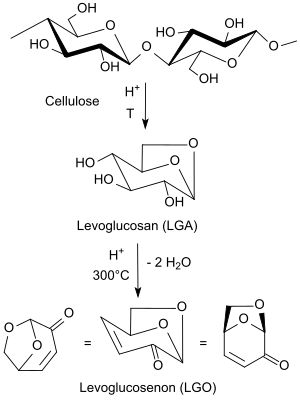
Beim Erhitzen von Cellulose in Tetrahydrofuran auf 210 °C in Gegenwart niedriger Konzentrationen von Schwefelsäure im Autoklaven wird in einer so genannten lösemittelassistierten Pyrolyse bis zu 51 % Levoglucosenon erhalten.[6] Unter optimierten Bedingungen in Laboransätzen können Ausbeuten an Levoglucosenon bis zu 95 % erzielt werden.[7]
Cellulosehaltige Abfälle aus Bioraffinerien liefern bereits unter Mikrowellenbestrahlung bei 180 °C für fünf Minuten 6 bis 8 % LGO neben den üblichen Zersetzungsprodukten, wie z. B. Hydroxymethylfurfural HMF, Ameisensäure, Formaldehyd, CO2 und Wasser.[8]
Hydrierung des α,β-ungesättigten Ketons Levoglucosenon (LGO) an Platinmetall-Katalysatoren, wie z. B. Palladium auf Aluminiumoxid Pd/Al2O3, bei 40 °C führt selektiv zu Dihydrolevoglucosenon H2-LGO.[9]

Bei höheren Temperaturen wird das gesättigte Keton H2-LGO zum sekundären Alkohol Levoglucosanol und weiter zu Tetrahydrofuran-2,5-dimethanol hydriert.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]

Dihydrolevoglucosenon ist eine klare farblose bis hellgelbe Flüssigkeit mit vergleichsweise hoher dynamischer Viskosität von 14,5 cP[10] (zum Vergleich DMF: 0,92 cP bei 20 °C, NMP: 1,67 cP bei 25 °C) und mildem rauchig ketonartigem Geruch,[2] die mit Wasser und vielen organischen Lösungsmitteln mischbar ist.[2] Die Verbindung ist bei Temperaturen bis 140 °C und gegenüber schwachen Säuren und Basen stabil. Mit anorganischen Basen reagiert H2-LGO unter Aldolkondensation. Dihydrolevoglucosenon ist leicht bioabbaubar (99 % innerhalb von 14 Tagen), reagiert aber gegenüber Oxidationsmitteln wie wässriger 30%iger Wasserstoffperoxid-Lösung bereits bei Raumtemperatur heftig. Der hohe Siedepunkt von 227 °C ist für die Abtrennung und Aufarbeitung nachteilig.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Dihydroglucosenon als Präkursor
[Bearbeiten | Quelltext bearbeiten]Dihydrolevoglucosenon ist Ausgangsverbindung für eine Reihe von Folgeprodukten, die als biobasierte Molekülbausteine (engl. building blocks) für Wirkstoffe oder Monomere für Polykondensate von Interesse sind.[9] Bei der Oxidation von H2-LGO mit Persäuren, wie z. B. Peressigsäure in Essigsäure entsteht praktisch quantitativ optisch reines 5-Hydroxymethyldihydrofuranon [(S)-(+)-4-Hydroxymethyl-γ-butyrolacton],[3] aus dem das früher als HIV-Medikament eingesetzte Zalcitabin (2'-3'-Didesoxycytidin, ddC)[11] zugänglich ist.

In einem zweistufigen Hydrierprozess an Platinkatalysatoren zunächst bei 60 °C und anschließend bei 180 °C wird über mehrere Zwischenstufen hauptsächlich 1,6-Hexandiol erhalten,[12] das als Diolkomponente in Polyestern und Polyurethanen oder als Ausgangsstoff für das Diamin 1,6-Diaminohexan Verwendung findet.
Bei gezielter Temperaturführung und Verwendung geeigneter Palladiumkatalysatoren kann durch Hydrogenolyse von Dihydroglucosenon über Levoglucosanol selektiv Tetrahydrofuran-2,5-dimethanol (THF-dimethanol) erhalten werden,[9] das sich als bioabbaubares Lösungsmittel eignet und eine biobasierte Vorstufe für 1,6-Hexandiol (und 1,6-Diaminohexan) ist.[13]

Dihydroglucosenon als neuartiges polares Lösungsmittel
[Bearbeiten | Quelltext bearbeiten]Herkömmliche, d. h. aus fossilen Rohstoffen hergestellte aprotisch dipolare Lösungsmittel, wie Dimethylformamid, Dimethylacetamid, N-Methyl-2-pyrrolidon (NMP), Dichlormethan, Acetonitril, Dimethylsulfoxid u. a. stehen wegen ihres Umweltprofils (schlechte Bioabbaubarkeit, Bildung von NOx bzw. SOx bei der Verbrennung), ihrer akuten und chronischen Toxizität und ihrer nachgewiesenen oder vermuteten Mutagenität unter zunehmender Kritik. Die Suche nach alternativen „grünen“ Lösungsmitteln aus nichtverwertbarer Biomasse oder preisgünstigen erneuerbaren Rohstoffen, die durch hocheffiziente Prozesse in hoher Ausbeute zugänglich sind und das Leistungsprofil konventioneller Lösungsmittel möglichst weitgehend erfüllen,[14] hat weltweit in Industrie und Wissenschaft intensive Forschungsaktivitäten ausgelöst.
Ein aussichtsreicher Kandidat als „grünes“ aprotisch dipolares Lösungsmittel könnte Dihydrolevoglucosenon sein.[4] In mehreren Standardreaktionen der Organischen Chemie, z. B. der Menschutkin-Reaktion,[4] der Sonogashira-Kupplung[15], der Suzuki-Miyaura-Kupplung[16] oder der Synthese organischer Harnstoffe[17] zeigte Dihydrolevoglucosenon vergleichbare und z. T. bessere Eigenschaften als die Vergleichslösungsmittel.
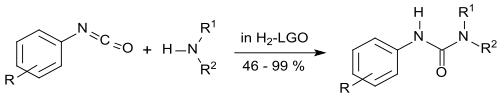
Nach einer Verlautbarung der Unternehmensleitung der australischen Circa Group schnitt Dihydrolevoglucosenon in 35 % der seit 2015 durchgeführten Versuche schlechter, in 45 % vergleichbar und in 20 % besser ab als NMP und ähnliche Lösungsmittel.[18] Das Unternehmen produziert Kleinmengen von Dihydrolevoglucosenon in einer gemeinsam mit dem norwegischen Unternehmen Norske Skog aufgebauten Pilotanlage mit einer Kapazität von 50 Jahrestonnen (FC5) unter der Marke CyreneTM in Tasmanien.[19] In einem weiteren Schritt ist eine kommerzielle Produktion von 5000 Tonnen CyreneTM im Jahr auf der Basis von Sägemehl der tasmanischen Boyer Mil geplant.[20]
Literatur
[Bearbeiten | Quelltext bearbeiten]- D.S. van Es: Study into alternative (biobased) polar aprotic solvents. Wageningen University, Wageningen 2017 (wur.nl [PDF]).
- J.H. Clark, A. Hunt, C. Topi, G. Paggiola, J. Sherwood: Sustainable Solvents: Perspectives from Research, Business and Institutional Policy. Royal Society of Chemistry, London 2017, ISBN 978-1-78262-335-9.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Datenblatt Cyrene, 99% bei Sigma-Aldrich, abgerufen am 5. Januar 2018 (PDF).
- ↑ a b c d Circa: Data Sheet: CyreneTM ( vom 9. Januar 2018 im Internet Archive)
- ↑ a b Patent US5112994: Method of producing (S)-4-hydroxymethyl-γ-lactone. Angemeldet am 17. September 1990, veröffentlicht am 12. Mai 1992, Anmelder: Japan Tobacco Inc., Yuki Gosei Kogyo Co., Ltd., Erfinder: K. Koseki, T. Ebata, H. Kawakami, H. Matsushita, K. Itoh, Y. Naoi.
- ↑ a b c James Sherwood, Mario de Bruyn, Andri Constantinou, Laurianne Moity, C. Rob McElroy, Thomas J. Farmer, Tony Duncan, Warwick Raverty, Andrew J. Hunt, James H. Clark: Dihydrolevoglucosenone (Cyrene) as a bio-based alternative for dipolar aprotic solvents. In: Chem. Commun. Band 50, 2014, S. 9650–9652, doi:10.1039/C4CC04133J.
- ↑ W.S. Trehanovsky, C. Wang, J.M. Ochaoda, C. Chang: A convenient procedure for the preparation of levoglucosenone from cellulose and the conversion of levoglucosenone to novel chiral derivatives. In: ACS Symposium Series. Band 841, 2003, Kap. 2, S. 228–230, doi:10.1021/bk-2003-0841.ch002.
- ↑ F. Cao, T.J. Schwartz, D.J. McClelland, S.H. Krishna, J.A. Dumesic, G.W. Huber: Dehydration of cellulose to levoglucosenone using polar aprotic solvents. In: Energy Environ. Sci. Band 8, 2015, S. 1808–1815, doi:10.1039/C5EE00353A.
- ↑ Patent US9376451B1: Method for selectively preparing levoglucosenone (LGO) and other anhydrosugars from biomass in polar aprotic solvents. Angemeldet am 31. Dezember 2014, veröffentlicht am 28. Juni 2016, Anmelder: Wisconsin Alumni Research Foundation, Erfinder: G.W. Huber, F. Cao, J.A. Dumesic, T.J. Schwartz.
- ↑ M. De bruyn, J. Fan, V. L. Budarin, D. J. Macquarrie, L. D. Gomez, R. Simister, T. J. Farmer, W. D. Raverty, S. J. McQueen-Mason, J. H. Clark: A new perspective in bio-refining: levoglucosenone and cleaner lignin from waste biorefinery hydrolysis lignin by selective conversion of residual saccharides. In: Energy Environ. Sci. Band 9, 2016, S. 2571–2574, doi:10.1039/c6ee01352j.
- ↑ a b c S.H. Krishna, D.J. McClelland, Q.A. Rashke, J.A. Dumesic, G.W. Huber: Hydrogenation of levoglucosenone to renewable chemicals. In: Green Chem. Band 19, 2017, S. 1278–1285, doi:10.1039/C6GC03028A.
- ↑ H.J. Salavagione, J. Sherwood, M. De bruyn, V.L. Budarin, G.J. Ellis, J.H. Clark, P.S. Shuttleworth: Identification of high performance solvents for the sustainable processing of graphene. In: Green Chem. Band 19, 2017, S. 2550–2560, doi:10.1039/C7GC00112F.
- ↑ M. Okabe, R.C. Sun, S.Y.K. Tam, L.J. Todaro, D.L. Coffen: Synthesis of the dideoxynucleosides “ddC” and “CNT” from glutamic acid, ribonolactone, and pyrimidine bases. In: J. Org. Chem. Band 53, Nr. 20, 1988, S. 4780–4786, doi:10.1021/jo00255a021.
- ↑ Patent US8889912B2: Process for preparing 1,6-hexanediol. Angemeldet am 25. April 2013, veröffentlicht am 18. November 2014, Anmelder: E.I. du Pont de Nemours and Company, Erfinder: A.M. Allgeier, D.R. Corbin, W.I.N. De Silva, E. Korovessi, C.A. Menning, J.C. Ritter, S.K. Sengupta.
- ↑ Jiayue He, Kefeng Huang, Kevin J. Barnett, Siddarth H. Krishna, David M. Alonso, Zachary J. Brentzel, Samuel P. Burt, Theodore Walker, Williams F. Banholzer, Christos T. Maravelias, Ive Hermans, James A. Dumesic, George W. Huber: New catalytic strategies for α, ω-diols production from lignocellulosic biomass. In: Faraday Disc. Band 202, 2017, S. 247–267, doi:10.1039/C7FD00036G.
- ↑ F.P. Byrne et al.: Tools and techniques for solvent selection: Green solvent selection guides. In: Sustain. Chem. Proc. Band 4, Nr. 7, 2016, S. 1–24, doi:10.1186/s40508-016-0051-z.
- ↑ K.L. Wilson, A.R. Kennedy, J. Murray, B. Greatrex, C. Jamieson, A.J.B. Wilson: Scope and limitations of a DMF bio-alternative within Sonogashira cross-coupling and Cacchi-type annulation. In: Beilstein J. Org. Chem. Band 12, 2016, S. 2005–2011, doi:10.3762/bjoc.12.187.
- ↑ K.L. Wilson, J. Murray, C. Jamieson, A.J.B. Watson: Cyrene as a bio-based solvent for the Suzuki-Miyaura cross-coupling. In: Synlett. Band 28, 2017, S. A–E, doi:10.1055/s-0036-1589143.
- ↑ L. Mistry, K. Mapesa, T.W. Bonsfield, J.E. Camp: Synthesis of ureas in the bio-alternative solvent Cyrene. In: Green Chem. Band 19, 2017, S. 2123–2128, doi:10.1039/C7GC00908A.
- ↑ The future of sustainability at Circa. Specialty Chemicals Magazine, 17. April 2017, archiviert vom ; abgerufen am 5. Januar 2018 (englisch).
- ↑ Press Release: Circa Group’s Commercial Demonstration Plant Comes Online and Produces First Batch of 99% Pure Cyrene®. Pressemitteilung bei Sustainable Consult, 12. Februar 2019; abgerufen am 24. März 2019.
- ↑ Government backs bio-based solvent project. ( vom 21. März 2019 im Internet Archive) Artikel auf print21.com.au, 1. März 2018; abgerufen am 24. März 2019.
