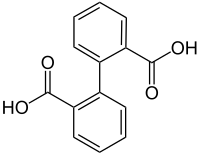
Diphensäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diphensäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C14H10O4 | |||||||||||||||
| Kurzbeschreibung |
grauweißes Pulver, monokline Prismen oder Plättchen, Nadeln[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 242,23 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,2917 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[4], löslich in organischen Lösungsmitteln[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Diphensäure (HOOCC6H4C6H4COOH) ist ein aromatische chemische Verbindung. Die Struktur besteht aus zwei Benzolringen mit je einer in ortho-Stellung angefügten Carboxygruppe (–COOH). Die Säure bildet ein inneres Anhydrid mit einem an die beiden Benzolringe anellierten siebengliedrigen Ring; das Anhydrid besitzt einen Schmelzpunkt von 219 °C.[5]

Gewinnung und Darstellung
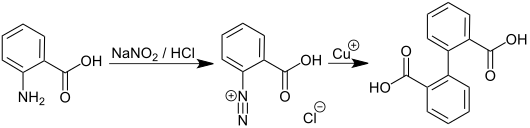
[Bearbeiten | Quelltext bearbeiten]Diphensäure kann aus Anthranilsäure durch Diazotierung und anschließende Einwirkung von Kupfer(I)-Ionen gewonnen werden:[6]
Auch ausgehend von Phenanthren ist sie zugänglich.[7] Hierbei wird zunächst Peroxyessigsäure aus Essigsäure und 90 % Wasserstoffperoxid hergestellt:
Anschließend wird diese mit Phenanthren umgesetzt:
Wird Phenanthren mit Oxidationsmitteln (z. B. Wasserstoffperoxid, Chrom(VI)-oxid, Kaliumdichromat, Kaliumpermanganat) behandelt, entsteht 9,10-Phenanthrenchinon und durch weitere Oxidation Diphensäure.[8][9]
Kocht man 9,10-Phenanthrenchinon mit alkoholischem Kali, so entsteht das Kaliumsalz der Diphensäure.[10]
Auch entsteht durch Photooxidation aus 9,10-Phenanthrenchinon die Diphensäure.[11]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Diphensäure kann zur Herstellung von Polyester- und Alkydharzen dienen.[12]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Diphensäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. August 2016.
- ↑ Carl Yaws: Thermophysical Properties of Chemicals and Hydrocarbons. William Andrew, 20. Juni 2014, ISBN 978-0-323-29060-9, S. 325.
- ↑ a b c Datenblatt Diphenic acid bei Sigma-Aldrich, abgerufen am 24. Februar 2013 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 96. Auflage. CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-48.
- ↑ D'Ans-Lax: Taschenbuch für Chemiker und Physiker. 4. Auflage, Band 2, Springer Verlag, 1982, ISBN 3-540-12263-X.
- ↑ E. R. Atkinson, H. J. Lawler.: Diphenic Acid In: Organic Syntheses. 7, 1927, S. 30, doi:10.15227/orgsyn.007.0030; Coll. Vol. 1, 1941, S. 222 (PDF).
- ↑ William F. O’Connor, Emil J. Moriconi: 2,2′-Diphenic Acid from Phenanthrene. In: Industrial & Engineering Chemistry. Band 45, Nr. 2, Februar 1953, S. 277–281, doi:10.1021/ie50518a020.
- ↑ C. R. Noller: Lehrbuch der Organischen Chemie. Springer-Verlag, 1960, ISBN 978-3-642-87325-6, S. 635, doi:10.1007/978-3-642-87324-9
- ↑ Hans Meyer: Synthese der Kohlenstoffverbindungen: Erster Teil: Offene Ketten und Isocyclen. Springer-Verlag, 1938, ISBN 978-3-7091-3245-6, S. 1170.
- ↑ Gustav Schultz: Die Chemie des Steinkohlentheers: Bd. Die Rohmaterialen. Friedrich Vieweg und Sohn, 1886.
- ↑ A. Coehn, G. Jung, J. Daimer: Photochemie und Photographische Chemikalienkunde. Springer Vienna, 1926, ISBN 978-3-7091-5255-3, S. 136, doi:10.1007/978-3-7091-5403-8
- ↑ Heinz-Gerhard Franck, Jürgen W. Stadelhofer: Industrielle Aromatenchemie: Rohstoffe-Verfahren-Produkte. Springer Berlin Heidelberg, 1987, ISBN 978-3-662-07875-4, S. 377, doi:10.1007/978-3-662-07875-4


