Diphenyldiselenid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diphenyldiselenid | |||||||||||||||
| Andere Namen |
Phenyldiselenid | |||||||||||||||
| Summenformel | C12H10Se2 | |||||||||||||||
| Kurzbeschreibung |
gelbe Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 312,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,557 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in vielen organischen Lösemitteln, unlöslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Diphenyldiselenid ist eine chemische Verbindung mit der Summenformel (C6H5)2Se2, abgekürzt auch als Ph2Se2. Der orangefarbene Feststoff ist ein oxidiertes Derivat des Selenophenols. Es wird in der organischen Synthese zum Einführen von PhSe-Einheiten benutzt.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Diphenyldiselenid wird gewonnen durch Umsetzung des Grignard-Reagenzes Phenylmagnesiumbromid (PhMgBr) mit Selen unter Erhitzen sowie anschließender Oxidation durch Brom (Br):[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Diphenyldiselenid besitzt eine zentrosymmetrische Struktur mit einer Se-Se-Bindungslänge von 2,29 A.[1]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Charakteristische Reaktionen von Diphenyldiselenid sind Reduktion und Chlorierung:
Phenylnatriumselenid (PhSeNa) ist ein nützliches Nukleophil, das benutzt werden kann, um durch nukleophile Substitution eines Alkylhalogenids, einer Mesylgruppe, einer Tosylgruppe oder eines Epoxids eine Phenylselenylgruppe einzuführen. Das nachfolgende Beispiel stammt aus der Morphinsynthese:[6]
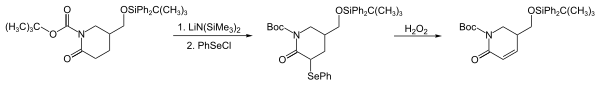
Phenylselenchlorid (PhSeCl) ist ein wirkungsvolles Elektrophil, mit dem Phenylselenylgruppen in zahlreiche Nukleophile wie Enolate, Enol-Silyl-Ether, Grignard-Verbindungen, Lithiumorganische Verbindungen, Alkene und Amine eingeführt werden können. In der nachfolgend gezeigten Reaktion (frühe Reaktionsschritte der Synthese von Strychnofolin) wird eine Phenylselenylgruppe durch die Reaktion von PhSeCl mit einem Lactam-Enolat eingeführt.[7] Die Reaktionssequenz ist eine wirkungsvolle Methode zur Umwandlung von Carbonylverbindungen in ihre α,β-ungesättigen Analoga.[8]
Diphenyldiselenid selbst ist ebenfalls eine Quelle für die schwach elektrophile Phenylselenylgruppe, es kann allerdings nur in Reaktion mit starken Nukleophilen wie Grignard-Reagenzien, Lithiumverbindungen und Enolestern benutzt werden. PhSeCl ist sowohl reaktiver wie auch effizienter, da mit Ph2Se2 die Hälfte des Selens verschwendet wird.
N-Phenylselenphthalimid (N-PSP) kann benutzt werden, falls PhSeCl zu stark und Diphenyldiselenid zu verschwenderisch ist.[9]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b R. E. Marsh: The crystal structure of diphenyl diselenide. In: Acta Crystallographica. Band 5, Nr. 4, 2. Juli 1952, S. 458–462, doi:10.1107/S0365110X52001349.
- ↑ a b c Eintrag zu Diphenyldiselenid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- ↑ a b c Datenblatt Diphenyl diselenide, 98% bei Sigma-Aldrich, abgerufen am 11. Februar 2013 (PDF).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Selenverbindungen mit Ausnahme von Cadmiumsulfoselenid, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Januar 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Hans J. Reich, Martin L. Cohen, Peter S. Clark: Reagents for Synthesis of Organoselenium Compounds: Diphenyl Diselenide and Benzeneselenenyl Chloride In: Organic Syntheses. 59, 1979, S. 141, doi:10.15227/orgsyn.059.0141; Coll. Vol. 6, 1988, S. 533 (PDF).
- ↑ Douglass F. Taber, Timothy D. Neubert, Arnold L. Rheingold: Synthesis of (−)-Morphine. In: Journal of the American Chemical Society. Band 124, Nr. 42, Oktober 2002, S. 12416–12417, doi:10.1021/ja027882h.
- ↑ Lerchner, A.; Carreira, E. M.: First Total Synthesis of (±)-Strychnofoline via a Highly Selective Ring-Expansion Reaction. In: Journal of the American Chemical Society. Vol. 124, Nr. 50, 2002, S. 14826–14827, doi:10.1021/ja027906k.
- ↑ Reich, H. J.; Wollowitz, S.: Preparation of α,β-Unsaturated Carbonyl Compounds and Nitriles by Selenoxide Elimination. In: Organic Reactions. Vol. 44, 1993, S. 1–296, doi:10.1002/0471264180.or044.01.
- ↑ A. F. Barrero, Alvarez-Manzaneda, E. J.; Chahboun, R.; Corttés, M.; Armstrong, V.: Synthesis and Antitumor Activity of Puupehedione and Related Compounds. In: Tetrahedron. Vol. 55, Nr. 52, 1999, S. 15181–15208, doi:10.1016/S0040-4020(99)00992-8.