Diphenylketen
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Diphenylketen | ||||||||||||
| Andere Namen |
2,2-Diphenylethenon | ||||||||||||
| Summenformel | C14H10O | ||||||||||||
| Kurzbeschreibung |
oranges Öl[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 194,23 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt | |||||||||||||
| Löslichkeit |
löslich in Benzol und Tetrahydrofuran[6] | ||||||||||||
| Brechungsindex |
1,615 (20 °C, 589 nm)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Diphenylketen wurde 1905 zuerst von Hermann Staudinger isoliert und als erster Vertreter der außerordentlich reaktiven Stoffklasse der Ketene[5] mit der allgemeinen Formel R1R2C=C=O (R1=R2=Phenylgruppe) identifiziert.[8] Mit den kumulierten Doppelbindungen in der Ketenstruktur R1R2C=C=O stellt Diphenylketen ein Heterokumulen dar. Die wichtigste Reaktion des Diphenylketens ist die [2+2]-Cycloaddition an C-C-, C-N-, C-O-, C-S-Mehrfachbindungen.[9]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die erste Synthese von H. Staudinger ging aus von Chlor-diphenyl-acetylchlorid (aus Benzilsäure und Thionylchlorid[10]), aus dem mit Zink in einer Dehalogenierungsreaktion zwei Chloratome abgespalten werden.[5]

Eine frühe Synthese nutzt Benzilmonohydrazon (aus Benzil und Hydrazinhydrat[11]), das mit Quecksilber(II)-oxid und Calciumsulfat zum Mono-diazoketon oxidiert und anschließend bei 100 °C unter Stickstoffabspaltung in 58%iger Ausbeute in das Diphenylketen umgelagert wird.[12]
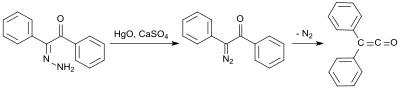
Eine weitere frühe Diphenylketen-Synthese stammt von Eduard Wedekind, der bereits 1901 bei der Dehydrohalogenierung von Diphenylacetylchlorid mit Triethylamin Diphenylketen erhielt, ohne es jedoch zu isolieren und zu charakterisieren.[13] Diese Variante wurde auch 1911 von H. Staudinger beschrieben.[14]
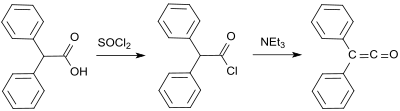
Eine Laborstandardvorschrift[1] basiert auf dem Staudinger-Verfahren und liefert Diphenylketen als orangefarbenes Öl in Ausbeuten von 53 bis 57 %.
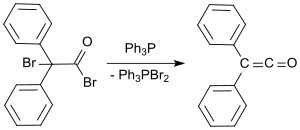
In einem jüngeren Verfahren wird 2-Brom-2,2-diphenylacetylbromid mit Triphenylphosphin in Ausbeuten bis 81 % zu Diphenylketen umgesetzt.[3]
Unlängst wurde eine Synthese von Diphenylketen aus Diphenylessigsäure und dem Hendrickson-Reagenz (Triphenylphosphoniumanhydrid-Triflat, aus Triphenylphosphinoxid und Trifluormethansulfonsäureanhydrid)[15][16] unter Wasserabspaltung in 72%iger Ausbeute berichtet.[17]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Diphenylketen ist bei Raumtemperatur ein orangefarbenes bis rotes Öl – mit der Farbe konzentrierter Kaliumdichromat-Lösung[5] –, das sich mit unpolaren organischen Lösungsmitteln wie z. B. Diethylether, Aceton, Benzol, Tetrahydrofuran, Chloroform mischt[6] und in der Kälte zu gelben Kristallen erstarrt.[5] Die Verbindung wird durch Luft leicht oxidiert, kann aber in dicht verschlossenen Behältnissen bei 0 °C mehrere Wochen ohne Zersetzung[1] bzw. in einer Stickstoffatmosphäre unter Zusatz einer kleinen Menge Hydrochinon als Polymerisationsinhibitor[12] aufbewahrt werden.
Die hohe Reaktivität des Diphenylketens manifestiert sich auch in der Bildung von drei definierten Dimeren:[18]
- das cyclische Diketon 2,2,4,4-Tetraphenylcyclobutan-1,3-dion (I) durch Erhitzen mit Chinolin
- das β-Lacton 4-(Diphenylmethylen)-3,3-diphenyloxetan-2-on (II) durch Erhitzen mit Natriummethanolat und
- das Tetralin-derivat 2,2,4-Triphenylnaphthalin-1,3-(2H,4H)-dion (III) durch Erhitzen mit Benzoylchlorid
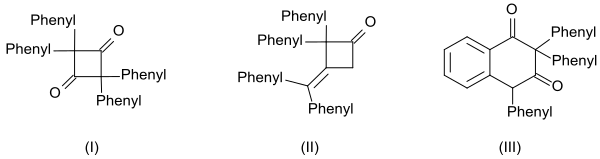
und daraus abgeleiteten höheren Oligomeren.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]In ihrer Konstitution wie in ihrer Reaktivität zeigen Ketene der allgemeinen Formel R1R2C=C=O viele Parallelen zu Isocyanaten der allgemeinen Formel R-N=C=O.
Diphenylketen addiert Wasser unter Bildung von Diphenylessigsäure, Ethanol zum Diphenylessigsäureethylester oder Ammoniak zum entsprechenden Amid.[5] Mit Carbonsäuren entstehen gemischte Anhydride der Diphenylessigsäure, die zur Aktivierung von geschützten Aminosäuren für die Peptidverknüpfung herangezogen werden können.

So entsteht bei der Aktivierung von Z-Leucin mit Diphenylketen und anschließender Umsetzung mit Phenylalanin-ethylester in 59%iger Ausbeute das geschützte Dipeptid Z-Leu-Phe-OEt (N-Benzyloxycarbonyl-L-leucyl-L-phenylalanin-ethylester).[19]
Diphenylketen neigt zur Autoxidation, bei der sich über ein intermediär entstehendes Diphenyl-Acetolacton bei Temperaturen über 60 °C der entsprechende Polyester bildet.[20]

In einer Wittig-Reaktion können aus Diphenylketen Allene dargestellt werden.[21]

Mit Triphenylphosphindiphenylmethylen und Diphenylketen entsteht z. B. bei 140 °C unter Druck Tetraphenylallen in 70%iger Ausbeute.[22]
Die synthetisch interessantesten Reaktionen des Diphenylketens sind [2+2]-Cycloadditionen, wie z. B. die Reaktion mit Cyclopentadien zu einem Diels-Alder-Addukt.[23]

Imine wie z. B. Benzalanilin bilden mit Diphenylketen β-Lactame
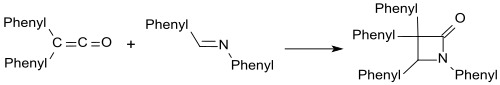
und mit Carbonylverbindungen entstehen analog β-Lactone.[23]
Die [2+2]-Cycloaddition von Diphenylketen mit Phenylacetylen führt zunächst zu einem Cyclobutenon, das thermisch zu einem Phenylvinylketen aromatisiert und in einer [4+2]-Cycloaddition in 81%iger Ausbeute zu 3,4-Diphenyl-1-naphthol cyclisiert.[24]

Aus dieser so genannten Smith-Hoehn-Reaktion hat sich eine allgemeine Synthesemethode für substituierte Phenole und Chinone entwickelt.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c E.C. Taylor, A. McKillop, G.H. Hawks: Diphenylketene In: Organic Syntheses. 52, 1972, S. 36, doi:10.15227/orgsyn.052.0036; Coll. Vol. 6, 1988, S. 549 (PDF).
- ↑ a b E. Lax: D'Ans-Lax, Taschenbuch für Chemiker und Physiker, 3. Aufl. Springer, Berlin 1964, ISBN 978-3-642-49526-7, S. 2–418.
- ↑ a b S.D. Darling, R.L. Kidwell: Diphenylketene. Triphenylphosphine dehalogenation of α-bromodiphenylacetyl bromide. In: J. Org. Chem. Band 33, Nr. 10, 1968, S. 3974–3975, doi:10.1021/jo01274a074.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 230 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f H. Staudinger: Ketene, eine neue Körperklasse. In: Ber. Dtsch. Chem. Ges. Band 38, Nr. 2, 1905, S. 1735–1739, doi:10.1002/cber.19050380283.
- ↑ a b c J.W. Leahy: Diphenylketene. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rd421.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b T.T. Tidwell: The first century of ketenes (1905–2005): The birth of a versatile family of reactive intermediates. In: Angew. Chem. Band 44, Nr. 36, 2005, S. 5778–5785, doi:10.1002/anie.200500098.
- ↑ H. Ulrich: Cycloaddition Reactions of Heterocumulenes. Academic Press, New York 1967, S. 374.
- ↑ F.E. King, D. Holmes: Synthetic mydriatics. Diphenylchloroacetyl chloride as a reagent for the preparation of benzylic esters of tertiary amino-alcohols. In: J. Chem. Soc. 1947, S. 164–168, doi:10.1039/JR9470000164.
- ↑ T. Curtius, K. Thun: Einwirkung von Hydrazinhydrat auf Monoketone und Orthodiketone. In: J. Prakt. Chem. Band 44, Nr. 2, 1891, S. 161–186, doi:10.1002/prac.18910440121.
- ↑ a b L.I. Smith, H.H. Hoehn: Diphenylketene In: Organic Syntheses. 20, 1940, S. 47, doi:10.15227/orgsyn.020.0047; Coll. Vol. 3, 1955, S. 356 (PDF).
- ↑ E. Wedekind: Ueber die Gewinnung von Säureanhydriden mit Hülfe von tertiären Aminen. In: Ber. Dtsch. Chem. Ges. Band 34, Nr. 2, 1901, S. 2070–2077, doi:10.1002/cber.190103402122.
- ↑ H. Staudinger: Über Ketene.XIX. Über Bildung und Darstellung des Diphenylketens. In: Ber. Dtsch. Chem. Ges. Band 44, Nr. 2, 1911, S. 1619–1623, doi:10.1002/cber.19110440258.
- ↑ Simon Nuß: Synthese neuer Ring-A-modifizierter Derivate des Alkaloids Luotonin A. (PDF; 2,9 MB) Universität Wien, 2012, S. 16, abgerufen am 2. April 2019 (Diplomarbeit).
- ↑ J.I. McCauley: Hendrickson reagent (triphenylphosphonium anhydride trifluormethane sulfonate). In: Synlett. Band 23, Nr. 20, 2012, S. 2999–3000, doi:10.1055/s-0032-1317486.
- ↑ Z. Moussa: The Hendrickson ‘POP’ reagent and analogues thereof: synthesis, structure, and application in organic synthesis. In: ARKIVOC. i, 2012, S. 432–490 (arkat-usa.org).
- ↑ H. Das, E.C. Kooyman: Oligomers of diphenylketene. In: Recl. Trav. Chim. Pays-Bas. Band 84, Nr. 8, 1965, S. 965–978, doi:10.1002/rec.19650840802.
- ↑ G. Losse, E. Demuth: Diphenylketen als Reagens zur Knüpfung von Peptidbindungen. In: Ber. Dtsch. Chem. Ges. Band 94, Nr. 7, 1961, S. 1762–1766, doi:10.1002/cber.19610940713.
- ↑ H. Staudinger, K. Dyckerhoff, H.W. Klever, L. Ruzicka: Über Autoxidation organischer Verbindungen. IV.: Über Autoxidation der Ketene. In: Ber. Dtsch. Chem. Ges. Band 58, Nr. 6, 1925, S. 1079–1087, doi:10.1002/cber.19250580618.
- ↑ G. Wittig, A. Haag: Über Phosphin-alkylene als olefinbildende Reagenzien, VIII. Allelderivate aus Ketenen. In: Ber. Dtsch. Chem. Ges. Band 96, Nr. 6, 1963, S. 1535–1543, doi:10.1002/cber.19630960609.
- ↑ G. Lüscher: Beitrag zur Konstitution der aliphatischen Diazokörper und Hydrazone. Neue organische Phosphorverbindungen. Hrsg.: Eidgenössische Technische Hochschule. Zürich 1922, doi:10.3929/ethz-a-000096667 (e-collection.library.ethz.ch [PDF]).
- ↑ a b H. Staudinger: Zur Kenntnis der Ketene. Diphenylketen. In: Liebigs Ann. Chem. Band 356, Nr. 1–2, 1907, S. 51–123, doi:10.1002/jlac.19073560106.
- ↑ L.I. Smith, H.H. Hoehn: The reaction of diphenylketene and phenylacetylene. In: J. Am. Chem. Soc. Band 61, Nr. 10, 1939, S. 2619–2624, doi:10.1021/ja01265a015.