Perowskit
| Perowskit | |
|---|---|
 | |
| Allgemeines und Klassifikation | |
| IMA-Symbol |
Prv[1] |
| Chemische Formel | CaTiO3 |
| Mineralklasse (und ggf. Abteilung) |
Oxide und Hydroxide |
| System-Nummer nach Strunz (8. Aufl.) Lapis-Systematik (nach Strunz und Weiß) Strunz (9. Aufl.) Dana |
IV/C.07 IV/C.10-010 4.CC.30 04.03.03.01 |
| Ähnliche Minerale | Uhligit, Latrappit, Tausonit |
| Kristallographische Daten | |
| Kristallsystem | orthorhombisch |
| Kristallklasse; Symbol | orthorhombisch-dipyramidal; 2/m2/m2/m |
| Raumgruppe | Pbnm (Nr. 62, Stellung 3)[2] |
| Gitterparameter | a = 5,39 Å; b = 5,45 Å; c = 7,65 Å[2] |
| Formeleinheiten | Z = 4[2] |
| Häufige Kristallflächen | {100}, {010}, {001} |
| Zwillingsbildung | Durchdringungszwillinge nach [010], seltener nach [121] |
| Physikalische Eigenschaften | |
| Mohshärte | 5,5 |
| Dichte (g/cm3) | 4,0 |
| Spaltbarkeit | undeutlich nach {001} |
| Bruch; Tenazität | muschelig |
| Farbe | schwarz, zum Teil rotbraun bis gelb |
| Strichfarbe | grau bis weiß |
| Transparenz | transluzent bis opak (undurchsichtig) |
| Glanz | Diamant- bis Metallglanz |
| Kristalloptik | |
| Brechungsindizes | nα = 2,300 nβ = 2,340 nγ = 2,380 |
| Doppelbrechung | δ = 0,080 |
| Optischer Charakter | zweiachsig positiv |
| Achsenwinkel | 2V = 88 bis 90° |
| Pleochroismus | nicht beobachtet |
| Weitere Eigenschaften | |
| Besondere Merkmale | piezoelektrisch |
Perowskit (auch Perovskit) ist ein relativ häufiges Mineral aus der Mineralklasse der „Oxide und Hydroxide“ mit der chemischen Zusammensetzung CaTiO3. Chemisch gesehen handelt es sich um ein Calcium-Titan-Oxid beziehungsweise Calciumtitanat, also eine Verbindung aus der Gruppe der Titanate. Die Kristalle des Perowskits bilden meist metallisch wirkende würfelähnliche Formen mit einer schwarzen bis rotbraunen Farbe.
Die Perowskit-Struktur ist ein wichtiger Strukturtyp für technisch bedeutende Verbindungen wie Ferroelektrika. Der Begriff Perowskit-Struktur bezieht sich dabei auf die kubische Kristallstruktur, obwohl diese im namensgebenden Perowskit CaTiO3 nicht exakt vorliegt. CaTiO3 kristallisiert wegen des zu kleinen Ionenradius des Ca2+-Ions stattdessen im niedrigersymmetrischen orthorhombischen Kristallsystem.
Im erweiterten Sinn werden auch Kristalle anderer Verbindungen mit einer Summenformel vom Typ ABO3 in Perowskit-Struktur als Perowskite bezeichnet.
Etymologie und Geschichte
[Bearbeiten | Quelltext bearbeiten]
Die Erstbeschreibung des Perowskit stammt von dem deutschen Mineralogen Gustav Rose (1798–1873) aus dem Jahr 1839.[3] Er entdeckte das noch unbekannte Mineral in der Druse einer Gesteinsprobe aus Achmatowsk in der Nähe von Slatoust (Ural), die er von dem Oberbergmeister Kämmerer aus St. Petersburg erhalten hatte.[4] Rose beschrieb die Kristallform, bestimmte die Härte (5,5 auf der Härteskala nach Mohs) sowie die Dichte des Minerals und führte zahlreiche chemische Untersuchungen durch, wodurch er die Bestandteile Calcium- und Titan(IV)-oxid zweifelsfrei bestimmen konnte. Er benannte das neue Mineral Perowskit nach dem russischen Politiker und Mineralogen Lew Alexejewitsch Perowski (1792–1856). Achmatowsk ist heute die Typlokalität des Perowskit.
Seit der Gründung der International Mineralogical Association ist Perowskit der international anerkannte Mineralname für das natürlich auftretende Calciumtitanoxid CaTiO3.
Klassifikation
[Bearbeiten | Quelltext bearbeiten]Bereits in der seit 1977 veralteten 8. Auflage der Mineralsystematik nach Strunz gehörte der Perowskit zur Mineralklasse der „Oxide und Hydroxide“ und dort zur Abteilung „M2O3- und verwandte Verbindungen“, wo er als Namensgeber die „Perowskit-Gruppe“ mit der System-Nr. IV/C.07 und den weiteren Mitgliedern Dysanalyt (diskreditiert als Varietät von Perowskit), Latrappit, Loparit (ehemals Loparit-(Ce)), Lueshit, Nioboloparit (diskreditiert als Varietät von Loparit), Uhligit (diskreditiert 2006) und Zirkelit bildete.
Im Lapis-Mineralienverzeichnis nach Stefan Weiß, das sich aus Rücksicht auf private Sammler und institutionelle Sammlungen noch nach dieser alten Form der Systematik von Karl Hugo Strunz richtet, erhielt das Mineral die System- und Mineral-Nr. IV/C.10-10. In der „Lapis-Systematik“ entspricht dies der Abteilung „Oxide mit [dem Stoffmengen]Verhältnis Metall : Sauerstoff = 2 : 3 (M2O3 und Verwandte)“, wo Perowskit zusammen mit Barioperowskit, Isolueshit, Lakargiit, Latrappit, Loparit, Lueshit, Macedonit, Megawit, Natroniobit, Pauloabibit, Tausonit und Vapnikit die „Perowskit-Reihe“ bildet (Stand 2018).[5]
Die seit 2001 gültige und von der International Mineralogical Association (IMA) zuletzt 2009 aktualisierte[6] 9. Auflage der Strunz’schen Mineralsystematik ordnet den Perowskit dagegen in die erweiterte Abteilung der „Oxide mit dem Stoffmengenverhältnis Metall : Sauerstoff = 2 : 3, 3 : 5 und vergleichbare“ ein. Diese ist zudem weiter unterteilt nach der relativen Größe der beteiligten Kationen, so dass das Mineral entsprechend seiner Zusammensetzung in der Unterabteilung „Mit großen und mittelgroßen Kationen“ zu finden ist, wo es zusammen mit Lueshit die „Perowskit-Lueshit-Gruppe“ mit der System-Nr. 4.CC.30 und den weiteren Mitgliedern Barioperowskit, Lakargiit, Latrappit und Natroniobit bildet.
Auch die vorwiegend im englischen Sprachraum gebräuchliche Systematik der Minerale nach Dana ordnet den Perowskit in die Klasse der „Oxide und Hydroxide“ und dort in die Abteilung der „Oxide“ ein. Hier ist er ebenfalls Namensgeber der „Perowskit-Gruppe“ mit der System-Nr. 04.03.03 und den weiteren Mitgliedern Latrappit, Loparit, Lueshit, Tausonit, Isolueshit, Barioperowskit und Lakargiit innerhalb der Unterabteilung der „Einfachen Oxide mit einer Kationenladung von 3+ (A2O3)“ zu finden.
Kristallstruktur
[Bearbeiten | Quelltext bearbeiten] Kristallstruktur von Perowskit _ Ca2+ _ Ti4+ _ O2− | |
| Kristallsystem | orthorhombisch |
| Raumgruppe (Nr.) | Pbnm (Nr. 62) |
| Gitterparameter | a = 5,39 Å b = 5,45 Å c = 7,65 Å |
| Formeleinheiten | Z = 4 |
Perowskit kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pbnm (Raumgruppen-Nr. 62, Stellung 3) mit den Gitterparametern a = 5,39 Å, b = 5,45 Å und c = 7,65 Å sowie vier Formeleinheiten pro Elementarzelle.
Idealerweise würde Perowskit im kubischen Kristallsystem in der Raumgruppe Pm3m (Raumgruppen-Nr. 221) mit einem Gitterparameter der Elementarzelle von ca. 3,80 Å kristallisieren. Aufgrund des dafür zu kleinen Ionenradius der Ca2+-Kationen ist die Kristallstruktur von CaTiO3 jedoch verzerrt, wodurch sich die niedrigere orthorhombische Symmetrie erklärt. Der Begriff Perowskit-Struktur als wichtiger Strukturtyp bezieht sich in der Regel auf die kubische Kristallstruktur, in welcher der namensgebende Prototyp selbst also nicht kristallisiert.

Die analogen Verbindungen der größeren Homologen des Calciums, Strontium und Barium, kristallisieren dagegen in der unverzerrten kubischen Struktur und jeweils nur einer Formeleinheit pro Elementarzelle:
- Strontiumtitanat SrTiO3, auch bekannt als das Mineral Tausonit, mit einem Gitterparameter von a = 3,90 Å
- Bariumtitanat BaTiO3, seit 2007 ebenfalls als Mineral bekannt (Barioperowskit), mit a = 4,01 Å.[7][8]
Der Grad der Verzerrung einer Verbindung ABO3 in der Perowskit-Struktur kann auch anhand des Goldschmidtschen Toleranzfaktors t abgeschätzt werden,[9] der wie folgt definiert ist:
mit
- dem Radius rA des A-Kations
- dem Radius rB des B-Kations
- dem Radius rO des Anions (für gewöhnlich Sauerstoff).
Die Perowskit-Struktur existiert in dem Bereich 0,89 < t < 1,02, wobei t = 1 dem Strontiumtitanat in der unverzerrten kubischen Struktur entspricht.
Die Kristallstruktur von Perowskit kann auf zwei verschiedene Arten beschrieben werden. Die Titanatome werden jeweils von sechs Sauerstoffatomen in der Gestalt von Oktaedern umgeben. Diese [TiO6]-Oktaeder bilden über gemeinsame Ecken ein dreidimensionales Netzwerk, das mit Hilfe der Niggli-Schreibweise wie folgt beschrieben werden kann:
In den Lücken dieses Netzwerks befinden sich die Calciumatome, die eine Koordinationssphäre aus zwölf Sauerstoffatomen in Form eines Kuboktaeders als Koordinationspolyeder besitzen. Alternativ kann die Struktur auch als kubisch dichteste Kugelpackung beschrieben werden, die gemeinsam von Calcium und Sauerstoff aufgebaut wird. Jede vierte Oktaederlücke der Kugelpackung ist dabei von Titan besetzt und zwar die, die nur von Sauerstoffatomen umgeben ist. Da in einer dichtesten Kugelpackung genauso viele Oktaederlücken wie Packungsteilchen vorhanden sind, ergibt sich wiederum die Summenformel CaTiO3.
Im kubischen Perowskit-Typ kristallisieren eine Reihe von weiteren Verbindungen, darunter industriell bedeutsame Ferroelektrika wie das bereits oben genannte Bariumtitanat (BaTiO3), aber auch andere Oxide wie CaZrO3 oder CaSnO3 sowie Fluoride und Nitride mit Zusammensetzungen wie z. B. KNiF3, KMnF3 und ThTaN3.
Die Ursache des häufigen Auftretens von Ferroelektrizität in Kristallen mit Perowskit-Struktur liegt in der hohen räumlichen Symmetrie der Gitterzelle. Am Ort des zentralen B-Kations (Ti4+) verschwindet aufgrund der Symmetrie der Gradient des Kristallfelds und damit die Rückstellkraft auf ein aus der Mittelposition ausgelenktes B-Kation, sodass sehr leicht ein elektrisches Dipolmoment induziert werden kann.
Von der Perowskit-Struktur können auch andere Strukturen abgeleitet werden. Im Perowskit gibt es nur eine Sorte von A-Atomen. Tauscht man die Hälfte aller A-Atome systematisch (also jedes zweite) gegen ein Atom A' aus, so erhält man die Elpasolith-Struktur (AA'B2O6). Deren Elementarzelle entspricht der achtfachen des Perowskits.
Entfernt man die von zwölf Sauerstoffatomen umgebenen Zentralatome (im Fall des Perowskits also die Calciumatome) aus der Struktur, entsteht ein weiterer häufiger Strukturtyp, die Rhenium(VI)-oxid-Struktur, die als Defektstrukturvariante der kubischen Perowskit-Struktur beschrieben werden kann.
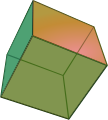
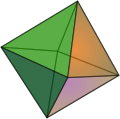
Morphologie
[Bearbeiten | Quelltext bearbeiten]Perowskit kristallisiert am häufigsten würfelförmig, wobei die Würfel aufgrund der orthorhombischen Symmetrie leicht verzerrt sind. Seltener sind oktaeder- oder kuboktaederförmige Einkristalle. Die Oktaederflächen sind, ebenso wie zum Teil auch Rhombendodekaederflächen, bei vielen würfelförmigen Kristallen zumindest angedeutet vorhanden. Die möglichen Kristallformen sind unten dargestellt.
Modifikationen und Varietäten
[Bearbeiten | Quelltext bearbeiten]
Magnet Cove, Arkansas USA
Perowskit kann neben Calcium und Titan Spuren bis hin zu größeren Mengen an anderen Metallen enthalten. Anstatt Calcium können Alkalimetalle, Seltenerdmetalle und seltener Eisen enthalten sein, auf den Titanpositionen befindet sich häufig auch Niob sowie untergeordnet Tantal und Zirconium.
Varietäten mit einem sehr hohen Gehalt an Seltenerdmetallen (vor allem Cer) werden als Knopit bezeichnet (nach Adolph Knop), sehr niobreiche Perowskite als Dysanalyt, bei einer Kombination aus beidem auch als Loparit. Unter Berücksichtigung der häufig enthaltenen Elemente, kann die chemische Zusammensetzung von Perowskit auch allgemeiner als (Ca,Na,Fe2+,Ce,Sr)(Ti,Nb)O3 angegeben werden.
Bildung und Fundorte
[Bearbeiten | Quelltext bearbeiten]
Perowskit entsteht durch Kristallisation aus titanreichen Magmen und ist ein häufiger Bestandteil von kieselsäurearmen (mafischen) Gesteinen wie Syenit, Kimberlit oder Karbonatit, er tritt aber auch in karbonatreichen Metamorphiten wie dem Skarn auf. Auch in karbonathaltigen Chondriten (Steinmeteoriten) konnte Perowskit nachgewiesen werden. Zu den begleitenden Mineralen (Paragenesen) zählen Nephelin (K,Na)AlSiO4, Titanit CaTiSiO5, Ilmenit FeTiO3, Magnetit Fe3O4, und – besonders bedeutsam – Melilith: Dessen Vorkommen zeigt das Vorkommen von Perowskit an (und umgekehrt).[10]
Weltweit gibt es zahlreiche Fundorte von Perowskit, neben der Typlokalität von Achmatowsk und weiterer Orte im Ural sind dies unter anderem die Halbinsel Kola (Russland), die Eifel und der Kaiserstuhl (Deutschland), Zermatt (Schweiz) sowie das Val di Susa und Val Malenco (Italien).
Künstlich kann Perowskit bei Temperaturen von mehr als 1300 °C durch die Reaktion von Calciumoxid CaO und Titandioxid TiO2 mit anschließender Kristallisation erzeugt werden:[11][12]
Der Schmelzpunkt des Endprodukts Calciumtitanat liegt bei 1975 °C und damit etwas höher als der von Titandioxid mit 1843 °C.
Vorkommen im Erdmantel
[Bearbeiten | Quelltext bearbeiten]Die dominierende Mineralphase des unteren Erdmantels (zwischen 660 und 2900 km Tiefe) wird ebenfalls als Perowskit bezeichnet. Es handelt sich hierbei um ein eisen- und magnesiumhaltiges Silikat mit der Zusammensetzung (Mg,Fe)SiO3, das die gleiche Kristallstruktur wie CaTiO3-Perowskit besitzt. Das magnesiumhaltige Endglied der Mischkristallreihe dieses silikatischen Perowskits wurde als natürliches Mineral im Tenham-Meteoriten nachgewiesen und erhielt 2014 den offiziellen Namen Bridgmanit.[13][14][15]
Verwendung von Materialien mit Perowskit-Struktur
[Bearbeiten | Quelltext bearbeiten]Perowskite wie Bariumtitanat finden Anwendung als Ferroelektrika und zum Beispiel als Dielektrika in Keramikkondensatoren. Mit von der Perowskit-Struktur abgeleiteten Verbindungen gelang den späteren Nobelpreisträgern Johannes Georg Bednorz und Karl Alexander Müller 1986 der Durchbruch bei den neuartigen keramischen Hochtemperatursupraleitern. Es handelte sich dabei um Lanthan-Barium-Kupferoxide.
Geeignete Perowskite können zum Bau von Leuchtdioden verwendet werden.[16][17]
Zudem können bestimmte Perowskite für die Herstellung von Solarzellen eingesetzt werden.[18] Eine Arbeitsgruppe um Michael Grätzel erreichte 2013 an kleinen Prototypen unter Laborbedingungen Wirkungsgrade von 15 %.[19] Anfang 2014 konnte unter Laborbedingungen ein Wirkungsgrad von – offiziell unbestätigten – 19,3 % erreicht werden.[20] Im Jahr 2017 gelang es Schweizer Forschern, die Effizienz auf über 22 Prozent zu steigern.[21] Den aktuellen zertifizierten Weltrekord mit einem Wirkungsgrad von 26,1 % hält das Forschungsteam um Professor Xu Jixian, welches der University of Science and Technology of China zugehörig ist.[22] Dieser Wirkungsgrad liegt nahe dem Rekord von Siliziumsolarzellen, der ohne Konzentration des Lichtes bei 27,1 % liegt[23]. Bemerkenswerter Weise erreichen die Perowskit Solarzellen diese Wirkungsgrade trotz einer weiteren Entfernung vom Shockley-Queisser-Limit. Die Leerlaufspannung liegt mit 1,2 V fast doppelt so hoch wie jene von Silizium Solarzellen, die bei circa 0,73 V liegt.[24] Problematisch ist bei Perowskiten als Solarzellenmaterial der notwendige Anteil an Blei, da bei einem Verbot des Einsatzes von Blei in Solarzellen in der EU im Rahmen der RoHS-Richtlinie die wirtschaftliche Verwertbarkeit in Frage steht.[25] Zudem sind Perowskit-Solarzellen empfindlich gegen Feuchtigkeit und haben bisher noch eine deutlich geringere Lebensdauer als Solarzellen aus anderen Materialien.[26] Mit neuen Forschungsansätzen sollen diese Probleme behoben werden.[27][28][29] Zwar ist es grundsätzlich möglich, Blei durch Zinn zu ersetzen, bisher blieben derartige Versuche jedoch weitgehend erfolglos, da Zinn allmählich oxidiert und damit die Kristallstruktur des Perowskites verlorengeht.[30] Mit Stand 2020 lag der Wirkungsgrad von bleifreien Perowskitzellen auf Basis einer CH3NH3SnI3-Struktur bei 18,71 %.[31] Als entscheidender Schritt für die Entwicklung von bleifreien Perowskitzellen gilt die Verhinderung der Oxidation des Zinnanteils in der Zelle, um die Langzeitstabilität zu gewährleisten. Falls dies gelingt, könnten binnen weniger Jahre bleifreie Perowskitzellen entwickelt werden, die nicht nur aus ungiftigen Materialien bestehen, sondern zugleich einen höheren Wirkungsgrad aufweisen als bleihaltige Perowskitzellen.[32]
2020 forschte ein Team um Professor Steve Albrecht an Tandemsolarzellen, bei denen herkömmliche Siliziumsolarzellen mit einer hauchdünnen Schicht aus Perowskit-Kristallen überzogen werden. Dadurch ließ sich die Stromausbeute der Solarmodule deutlich verbessern, sodass in Labortests ein Wirkungsgrad von mehr als 29 % erzielt werden konnte. Den aktuellen Weltrekord (stand März 2024) hält die Forschungsabteilung der Firma LONGi mit einem zertifizierten Wirkungsgrad von 33,9 % auf einem Quadratzentimeter Fläche.[33] Hierdurch haben Perwoskit-Silizium Tandemsolarzellen Wirkungsgrade erreicht, die jene von klassischen Einfachsolarzellen überschritten haben. Eine weitere Verbesserung des Wirkungsgrades bis zu 35 % wird von den Forschern für möglich gehalten.[34] Forschern am Lichttechnischen Institut des Karlsruher Institut für Technologie aus dem Arbeitskreis von T.T.-Professor Ulrich W. Paetzold gelang es 2022 zudem, skalierbare Tandemsolarzellenmodule nur auf Basis von Perowskiten mit einem Wirkungsgrad von 19,1 % herzustellen. Diese Technologie wird als besonders zukunftsrelevant gehandelt, da hierdurch ein vollständiger Verzicht von Siliziumsolarzellen möglich ist, welche in der Herstellung durch die Schmelze enorme Energiemengen benötigen. Der Amortisationszeitraum kann hierdurch stark herabgesetzt werden.[35]
Weitere Anwendungen
[Bearbeiten | Quelltext bearbeiten]Bei der Herstellung von Implantaten ermöglicht Perowskit die ungewöhnliche Verbindung von Titan bzw. seines Oxids mit dem biologischen Gewebe des Knochens: An der Oberfläche von rauen osseointegrierten Titanimplantaten entsteht unter biologischen Bedingungen Perowskit (CaTiO3). In diesem Kristall ist das Calcium des Knochens ionisch gebunden und nicht kovalent, was bis vor kurzem angenommen wurde. Auf der biologischen Seite bindet das positiv geladene Calciumion an die Loci der Poly-Anionen des langkettigen Glykosaminglykans der extrazellulären Matrix, auf der Kristallseite der Implantatoberfläche an den kovalent verbundenen Titan-Sauerstoff-Komplex. Der ionische Bindungstyp mit seinen geringeren Bindungskräften ermöglicht das vollständige Knochengewebsremodeling auch an der Implantatoberfläche, während eine kovalente Calciumbindung an und in den TiO2-Kristall das Calcium-Ion daran hindert, im permanenten Remodelingprozess zwischen Knochengewebe und dem Metall-Kristall frei verfügbar zu sein.[36]
Die Eidgenössische Materialprüfungs- und Forschungsanstalt Empa arbeitete 2017 in Kooperation mit der ETH Zürich an einem Farbsensor auf Perowskit-Basis, der höhere Auflösungen und Lichtempfindlichkeiten für Digitalkameras ermöglichen könnte.[37]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- W. A. Deer, R. A. Howie, J. Zussman: An Introduction to the Rock Forming Minerals. Prentice Hall, Harlow 1992, ISBN 0-582-30094-0 (englisch).
- Will Kleber, Hans-Joachim Bautsch, Joachim Bohm: Einführung in die Kristallographie. 18. Auflage. Verlag Technik, Berlin 1998, ISBN 3-341-01205-2.
- U. Müller: Anorganische Strukturchemie. 5. Auflage. Teubner, Stuttgart 2006, ISBN 3-8351-0107-2.
- Martin Okrusch, Siegfried Matthes: Mineralogie. Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7., vollständig überarbeitete und aktualisierte Auflage. Springer, Berlin [u. a.] 2005, ISBN 3-540-23812-3.
- Special issue: Perovskites. In: Science magazine. Band 358, Nr. 6365, 10. November 2017 (englisch, science.org).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Perowskit. In: Mineralienatlas Lexikon. Geolitho Stiftung
- Perowskite. In: mindat.org. Hudson Institute of Mineralogy (englisch).
- David Barthelmy: Perowskite Mineral Data. In: webmineral.com. (englisch).
- Perowskit-Struktur (CaTiO3-Typ, E21-Typ). In: ruby.chemie.uni-freiburg.de. Universität Freiburg, 13. Februar 2017.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Laurence N. Warr: IMA–CNMNC approved mineral symbols. In: Mineralogical Magazine. Band 85, 2021, S. 291–320, doi:10.1180/mgm.2021.43 (englisch, cambridge.org [PDF; 320 kB; abgerufen am 5. Januar 2023]).
- ↑ a b c R. H. Buttner, E. N. Maslen: Electron difference density and structural parameters in CaTiO3. In: Acta Crystallographica. B48, Nr. 5, 1992, S. 644–649, doi:10.1107/S0108768192004592.
- ↑ Gustav Rose: De novis quibusdam fossilibus, quae in montibus uraliis inveniuntur. I. De Perowskite, fossili novo. Univ., Antr.-Progr, Berlin 1839, S. 3–5 (Latein, Digitalisat).
- ↑ Gustav Rose: Ueber einige neue Mineralien des Urals. 1. Der Perowskit, eine neue Mineralspecies. In: Journal für praktische Chemie. Band 19, 1840, S. 459–460 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 20. Dezember 2021]).
- ↑ Stefan Weiß: Das große Lapis Mineralienverzeichnis. Alle Mineralien von A – Z und ihre Eigenschaften. Stand 03/2018. 7., vollkommen neu bearbeitete und ergänzte Auflage. Weise, München 2018, ISBN 978-3-921656-83-9.
- ↑ Ernest H. Nickel, Monte C. Nichols: IMA/CNMNC List of Minerals 2009. (PDF; 1,9 MB) In: cnmnc.units.it. IMA/CNMNC, Januar 2009, archiviert vom am 29. Juli 2024; abgerufen am 30. Juli 2024 (englisch).
- ↑ Y. A. Abramov, V. G. Tsirelson, V. E. Zavodnik, S. A. Ivanov, I. D. Brown: The chemical bond and atomic displacements in SrTiO3 from X-ray diffraction analysis. In: Acta Crystallographica. B51, Nr. 6, 1995, S. 942–951, doi:10.1107/S0108768195003752.
- ↑ R. H. Buttner, E. N. Maslen: Structural parameters and electron difference density in BaTiO3. In: Acta Crystallographica. B48, Nr. 6, 1992, S. 764–769, doi:10.1107/S010876819200510X.
- ↑ V. M. Goldschmidt: Die Gesetze der Krystallochemie. In: Die Naturwissenschaften. Band 14, Nr. 21, 1926, S. 477–485, doi:10.1007/BF01507527.
- ↑ William Scott MacKenzie, C. Guilford: Atlas gesteinsbildender Minerale in Dünnschliffen. Enke, Stuttgart 1981, ISBN 978-3-432-91911-9, S. 29.
- ↑ G. Pfaff: Synthesis of calcium titanate powders by the sol-gel process. In: Chemistry of Materials. Band 6, 1994, S. 58, doi:10.1021/cm00037a013 (englisch).
- ↑ Bruce Dunn, Jeffrey I. Zink: Sol–Gel Chemistry and Materials. In: Accounts of Chemical Research. Band 40, Nr. 9, 2007, S. 729, doi:10.1021/ar700178b, PMID 17874844 (englisch).
- ↑ Joanna Wendel: Mineral Named After Nobel Physicist. In: Eos, Zeitschrift der American Geophysical Union. Band 95, Nr. 23, 2014, S. 195, doi:10.1002/2014EO230005 (englisch).
- ↑ Oliver Tschauner: Discovery of davemaoite, CaSiO3-perovskite, as a mineral from the lower mantle. In: Science. Band 374, Nr. 6569, 2021, S. 891–894, doi:10.1126/science.abl8568 (englisch).
- ↑ Horst Rademacher: Edler Bote aus der Tiefe. FAZ.NET, 14. Dezember 2021, abgerufen am 20. Dezember 2021.
- ↑ Zhi-Kuang Tan, Reza Saberi Moghaddam, May Ling Lai, Pablo Docampo, Ruben Higler, Felix Deschler, Michael Price, Aditya Sadhanala, Luis M. Pazos, Dan Credgington, Fabian Hanusch, Thomas Bein, Henry J. Snaith & Richard H. Friend: Bright light-emitting diodes based on organometal halide perovskite. In: Nature Nanotechnology. Band 9, 3. August 2014, S. 687–692, doi:10.1038/nnano.2014.149 (englisch, researchgate.net [PDF; 877 kB; abgerufen am 20. Dezember 2021]).
- ↑ Katja Maria Engel: In Solarzellen brillieren sie bereits. Jetzt sollen Perowskite auch TV-Bildschirme zum Leuchten bringen. Neue Zürcher Zeitung, 3. Oktober 2020, abgerufen am 16. Dezember 2021.
- ↑ Yuandi Li: Reducing the cost of perovskite solar cells. In: www.rsc.org. Chemistry World, 18. April 2013, archiviert vom am 12. Mai 2016; abgerufen am 16. November 2019.
- ↑ J. Burschka, N. Pellet u. a.: Sequential deposition as a route to high-performance perovskite-sensitized solar cells. In: Nature. Band 499, Nr. 7458, Juli 2013, ISSN 1476-4687, S. 316–319, doi:10.1038/nature12340, PMID 23842493 (englisch).
- ↑ Martin A. Green, Anita Ho-Baillie, Henry J. Snaith: The emergence of perovskite solar cells. In: Nature Photonics. Band 8, Nr. 7, 2014, ISSN 1749-4885, S. 506–514, doi:10.1038/nphoton.2014.134 (englisch).
- ↑ futurezone: Forschern gelingt Durchbruch bei Perowskit-Solarzellen. In: futurezone.at. Abgerufen am 16. November 2019.
- ↑ USTC Set New Record in Perovskite Cell Efficiency-University of Science and Technology of China. Abgerufen am 29. Oktober 2023.
- ↑ Best Research-Cell Efficiency Chart. Abgerufen am 1. März 2024 (englisch).
- ↑ Interactive Best Research-Cell Efficiency Chart. Abgerufen am 29. Oktober 2023 (englisch).
- ↑ Boris Hänßler: Solarzellen aus Perowskit. spektrum.de, 13. Dezember 2013, abgerufen am 16. November 2019.
- ↑ Perowskit-Kristall: Neue Solarenergiequelle. 14. August 2014, abgerufen am 16. November 2019.
- ↑ Sascha Mattke: Photovoltaikforscher arbeiten an effizienten Solarmodulen mit Silizium und Perowskit. In: heise.de. Heise online, 19. Januar 2016, abgerufen am 16. November 2019.
- ↑ Rui Wang, Jingjing Xue, Lei Meng, Jin-Wook Lee, Zipeng Zhao, Pengyu Sun, Le Cai, Tianyi Huang, Zhengxu Wang, Zhao-Kui Wang, Yu Duan, Jonathan Lee Yang, Shaun Tan, Yonghai Yuan, Yu Huang, Yang Yang: Caffeine Improves the Performance and Thermal Stability of Perovskite Solar Cells. In: Joule. Band 3, Nr. 6, 2019, S. 1464–1477, doi:10.1016/j.joule.2019.04.005 (englisch).
- ↑ Alexander Stark: Highly Efficient Alternative for Silicon-Based Solar Cells Could Be Available Soon. In: lab-worldwide.com. 31. März 2021, abgerufen am 16. Dezember 2021 (Bericht aus der japanischen Forschung der Kanazawa Universität).
- ↑ Nicola Armaroli, Vincenzo Balzani: Solar Electricity and Solar Fuels: Status and Perspectives in the Context of the Energy Transition. In: Chemistry – A European Journal. Band 22, Nr. 1, 2016, S. 32–57, doi:10.1002/chem.201503580.
- ↑ Ke Xu: Development of tin-based perovskite materials for solar cell applications: A minireview. In: Instrumentation Science & Technology. Band 49, Nr. 1, 2. Januar 2021, ISSN 1073-9149, S. 91–105, doi:10.1080/10739149.2020.1785891 (tandfonline.com [abgerufen am 29. Oktober 2023]).
- ↑ Nakita K. Noel et al.: Lead-free organic–inorganic tin halide perovskites for photovoltaic applications. In: Energy and Environmental Science. Band 7, 2014, S. 3061–3068, doi:10.1039/c4ee01076k.
- ↑ NREL Efficiency Chart. 1. März 2024, abgerufen am 1. März 2024 (amerikanisches Englisch).
- ↑ Michael O. R. Kröher: Deutscher Starforscher entwickelt die Solarzellen der Zukunft. Manager Magazin, 6. Dezember 2021, abgerufen am 16. Dezember 2021.
- ↑ Bahram Abdollahi Nejand, David B. Ritzer, Hang Hu, Fabian Schackmar, Somayeh Moghadamzadeh, Thomas Feeney, Roja Singh, Felix Laufer, Raphael Schmager, Raheleh Azmi, Milian Kaiser, Tobias Abzieher, Saba Gharibzadeh, Erik Ahlswede, Uli Lemmer, Bryce S. Richards, Ulrich W. Paetzold: Scalable two-terminal all-perovskite tandem solar modules with a 19.1% efficiency. In: Nature Energy. Band 7, Nr. 7, Juli 2022, ISSN 2058-7546, S. 620–630, doi:10.1038/s41560-022-01059-w (nature.com [abgerufen am 29. Oktober 2023]).
- ↑ A. J. A. Wirthmann, C. Paulmann: Wechselwirkung von Knochen und Titan – Neue Einblicke in die ungewöhnliche „Hochzeit“ von Knochen und Metall. In: Zeitschrift für Zahnärztliche Implantologie. Band 30, Nr. 4, 2014, S. 288–300 (online-zzi.de [PDF; 1,7 MB; abgerufen am 20. Dezember 2021]).
- ↑ Karin Weinmann: Der gestapelte Farbsensor. In: empa.ch. 16. November 2017, abgerufen am 20. August 2019.

![{\displaystyle \mathrm {{}_{\infty }^{3}\lbrace [TiO{}_{6/2}^{e}]^{2-}\rbrace \!\,} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2e5fc1a02aa24cfb63d6f3719ef80e17d6c561f)