Aortenaneurysma
| Klassifikation nach ICD-10 | |
|---|---|
| I71 | Aortenaneurysma und -dissektion |
| I71.1 | Aneurysma der Aorta thoracica, rupturiert |
| I71.2 | Aneurysma der Aorta thoracica, ohne Angabe einer Ruptur |
| I71.3 | Aneurysma der Aorta abdominalis, rupturiert |
| I71.4 | Aneurysma der Aorta abdominalis, ohne Angabe einer Ruptur |
| I71.5 | Aortenaneurysma, thorakoabdominal, rupturiert |
| I71.6 | Aortenaneurysma, thorakoabdominal, ohne Angabe einer Ruptur |
| ICD-10 online (WHO-Version 2019) | |

Als Aortenaneurysma wird eine Aussackung (Aneurysma) der Hauptschlagader (Aorta) bezeichnet. Man unterscheidet Aneurysmen der Aorta in der Höhe des Brustkorbes von abdominellen (Bauch-)Varianten. Bei fortgeschrittenem Aneurysma droht eine Ruptur mit einer hohen Sterblichkeitsrate.
Bauchaortenaneurysma
[Bearbeiten | Quelltext bearbeiten]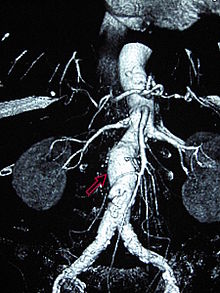
Als Bauchaortenaneurysma (BAA), abdominales Aortenaneurysma (AAA) oder Aneurysma verum aortae abdominalis wird eine Erweiterung der abdominalen Aorta unterhalb des Abgangs der Nierenarterien im anterioposterioren Durchmesser auf über 30 mm angesehen. Klinisch unterscheidet man zwischen asymptomatischen, symptomatischen und rupturierten Aneurysmata. Beim asymptomatischen (schmerzfreien) Aneurysma handelt es sich um einen Zufallsbefund. Beim symptomatischen Aneurysma stehen die Symptome und bei den rupturierten die Kreislaufsituation im Vordergrund.
Symptome
[Bearbeiten | Quelltext bearbeiten]Die Symptome für ein Bauchaortenaneurysma sind schwer zu erkennen und leicht mit anderen Krankheitsbildern wie dem akuten Herzinfarkt zu verwechseln. Diffuse Bauch- und Rückenschmerzen, ein schlecht tastbarer, unterschiedlich starker Leistenpuls und Schwindelgefühl können Symptome sein. Unter Umständen ist ein pulsierender Tumor als Anzeichen für die Aussackung im Bauchraum zu tasten. Die Gefahr durch das Aneurysma geht von der Möglichkeit einer Ruptur aus. Die im Retroperitonealraum befindliche Aorta reißt ein, die Einblutung wird jedoch durch das Peritoneum zurückgehalten und kann unter Umständen mehrere Tage unbemerkt fortschreiten. Von den Betroffenen wird ein akuter Vernichtungsschmerz im Abdominalbereich beschrieben. Hinzu kann eine Schock-Symptomatik mit Blutdruckabfall, subjektiver Atemnot, Todesangst und ischämischer Symptomatik in den unteren Extremitäten kommen. Diese Symptome können mehr oder weniger stark ausgeprägt sein und erschweren eine Abgrenzung gegen einen Herzinfarkt oder einen arteriellen Gefäßverschluss präklinisch sehr. Auch ein beschwerdefreies Leben mit einem Aortenaneurysma ist möglich, so werden viele Aneurysmen erst bei Routineuntersuchungen zufällig entdeckt.
In der Laboruntersuchung der Blutwerte findet sich bei einem akuten Aortenaneurysma ein stark erhöhtes D-Dimer. Dies kann im Umkehrschluss auch als Ausschlusskriterium benutzt werden, da bei einem gar nicht oder nur wenig erhöhten D-Dimer ein Aneurysma höchstwahrscheinlich nicht vorliegt. Dies erklärt sich durch eine starke Gerinnungsaktivität im Fall des akuten Aortenaneurysmas, da hier ein Gefäßwandeinriss vorliegt, den der Körper zu verschließen versucht.
Diagnose
[Bearbeiten | Quelltext bearbeiten]Die Diagnose eines AAA kann mittels verschiedener bildgebender Verfahren gesichert werden.[1]
- Die Ultraschalluntersuchung kann ein AAA mit einer Sensitivität und Spezifität von 90 % finden. Sie eignet sich aufgrund ihrer Strahlenfreiheit insbesondere als Screeningmethode sowie für die Verlaufskontrolle nicht behandelter Aneurysmata. Neuere Verfahren wie der kontrastmittelverstärkte Ultraschall werden für die regelmäßigen Kontrollen nach endovaskulärem Aortenrepair bei BAA hergenommen.
- Die Angiographie kann Aneurysmata nur bedingt zur Darstellung bringen, da sich das Kontrastmittel nur in durchströmten Anteilen des Gefäßes abbildet. Sie ist aber sehr gut geeignet, eventuelle Beteiligungen abgehender Gefäße (z. B. Nierenarterie) zu erkennen.
- Die Magnetresonanztomographie kann ein AAA in nahezu 100 % der Fälle darstellen, ist allerdings in der Notfalldiagnostik aufgrund der langen Untersuchungsdauer nicht anwendbar. Größenbestimmungen sind mittels MRT möglich. Vorbehandlungen mit metallhaltigen Stents können die Untersuchung stören oder unmöglich machen.
- Die Computertomographie gilt derzeit als Goldstandard zur Untersuchung eines AAA. Sie ist zwar mit einer Strahlenbelastung für den Patienten behaftet, kann aber sehr gut zur Größenbestimmung verwendet werden und die räumliche Ausdehnung des Aneurysmas zeigen. Auch Verkalkungen und evtl. schon eingesetzte Stents können untersucht werden. Moderne CTs liefern auch Bildrekonstruktionen, die zur OP-Planung eingesetzt werden können.
Operationsindikation
[Bearbeiten | Quelltext bearbeiten]Die Operation eines asymptomatischen AAA ist ein prophylaktischer Eingriff mit dem Ziel, eine Ruptur zu verhindern. Bei der Indikation zur Operation muss somit das Rupturrisiko gegen das Operationsrisiko abgewogen werden. Ein Rupturrisiko besteht bei jedem AAA, auch bei solchem mit weniger als vier Zentimetern Durchmesser. Es nimmt mit der Größe des Querdurchmessers zu und liegt bei 3 %/Jahr für AAA von unter fünf Zentimetern, 10 %/Jahr für solche von mehr als fünf Zentimetern. Weitere Faktoren, die das Rupturrisiko beeinflussen, sind die Form des Aneurysmas (sakkulär) sowie das Vorliegen eines entzündlichen Prozesses, einer Hypertonie, einer COPD, eines Nikotinabusus oder einer familiären Disposition. Für die Operationsindikation wird das Rupturrisiko ab einem Querdurchmesser von fünf Zentimetern als relevant beurteilt. Eine Kontrastmittelaufnahme in den Aneurysmasack im CT spricht für eine hämodynamische Relevanz und wird auch als Rupturrisiko eingestuft.

Die Operationsmortalität (Sterblichkeit) für elektive Eingriffe liegt in spezialisierten Kliniken im Durchschnitt deutlich unter drei Prozent. Aufgrund dieser Daten wird für Patienten mit einem normalen operativen Risiko die Operationsindikation bei einem Durchmesser des Aneurysmas von über fünf Zentimetern akzeptiert. Weitere Operationsindikationen stellen eine Wachstumstendenz von mehr als einem Zentimeter pro Jahr oder eine deutliche Asymmetrie des AAA (z. B. sakkuläre Ausbuchtung) dar. AAA mit einem Durchmesser von unter fünf Zentimetern mit normaler Konfiguration und ohne Wachstumstendenz stellen keine Operationsindikation dar. Selbstverständlich sind die allgemeinen Risiken des Patienten bei der Indikationsstellung mit zu berücksichtigen (Carotiden, Coronararterien). Das Behandlungsprinzip ist die Ausschaltung des Aneurysmas mit Wiederherstellung der Gefäßkontinuität. Im Aorten- und Beckenbereich besteht der Ersatz in einer Kunststoffprothese entweder als Rohr- oder Y-Prothese bei Mitbefall der Beckenarterien. Peripher, das heißt infrainguinal, erfolgt die Wiederherstellung durch einen Bypass oder Interponat mit autologem (Empfänger und Spender sind identisch) Venen-Material. Die Indikation zur notfallmäßigen bzw. beschleunigten Operation ist bei einem rupturierten oder symptomatischen Aneurysma gegeben.
Offene Operation eines Bauchaortenaneurysmas
[Bearbeiten | Quelltext bearbeiten]Der Eingriff kann über einen transabdominalen oder linksseitig retroperitonealen Zugang durchgeführt werden. Letzterer empfiehlt sich vor allem bei voroperiertem Abdomen (hostile abdomen). Die Präparation der Aorta erfolgt nach proximal mindestens bis zu beiden Nierenarterien und nach distal bis zum Erreichen eines gesunden Gefäßsegmentes. Anatomische Varianten, wie eine linksseitige Vena cava, eine retroaortale linke Nierenvene oder akzessorische Nierenarterien sind nicht selten und sollten vor der Operation erkannt werden. Das Abklemmen der Aorta erfolgt nach systemischer Gabe von 60 I.E. Heparin/kg i.v. wenn immer möglich infrarenal. Nach Längsinzision des AAA werden der Thrombussaum extrahiert, die rückblutenden Lumbalarterien übernäht und der Abgang der Arteria mesenterica inferior (AMI) patchförmig ausgeschnitten. Eine Gefäßprothese (Dacron- oder PTFE-) wird infrarenal anastomosiert (End-zu-End). Die distale Anastomosierung erfolgt je nach Ausdehnung des Aneurysmas auf die Aortenbifurkation (Rohrprothese) oder selektiv auf den ersten gesunden Gefäßabschnitt rechts und links (Y-Prothese). Zur Sicherstellung der Perfusion der Beckenorgane, des Sigmas und des Gesäßes sollte mindestens eine Arteria iliaca interna revaskularisiert und gegebenenfalls die AMI in die Prothese implantiert werden. Zum Schutz vor einer Darmarrosion wird der Aneurysmasack über der Prothese verschlossen und der gesamte Bereich mit Peritoneum gedeckt. Nach einer postoperativen Phase von 12–24 Stunden auf einer Überwachungsstation folgt die Entlassung nach ca. einer weiteren Woche nach Hause.
Frühe Letalität und Komplikationsrate
[Bearbeiten | Quelltext bearbeiten]Die perioperative Letalität einzelner spezialisierter Zentren beträgt unter zwei Prozent, in populationsbasierten Berichten oder Multizenterstudien fünf bis sieben Prozent. Sie wird direkt von patientenspezifischen Faktoren wie Alter, erhöhtem Kreatinin (> 1,8 mg/dl) oder dem Vorliegen kardiopulmonaler Risikofaktoren beeinflusst. Zudem hängt sie von der Erfahrung des behandelnden Zentrums und des Chirurgen in der Therapie von AAA ab.
Langzeitüberleben
[Bearbeiten | Quelltext bearbeiten]Die 5-Jahres-Überlebensrate beträgt zwischen 60 und 75 %. Sie wird hauptsächlich vom Vorliegen cardiovaskulärer Risikofaktoren bestimmt.
Spätkomplikationen der Prothese
[Bearbeiten | Quelltext bearbeiten]Spätkomplikationen sind nach Operation eines AAA selten. Pseudoaneurysmata im Bereich der Anastomosen kommen auf Grund degenerativer Veränderungen in ein bis zwei Prozent der Fälle nach drei Jahren vor. Protheseninfekte, typischerweise drei bis vier Jahre nach der Operation, sind mit 0,5 % ebenfalls selten. Aortoenterische Fisteln treten bei weniger als einem Prozent der Patienten auf.
Endovaskuläre Therapie des Bauchaortenaneurysmas
[Bearbeiten | Quelltext bearbeiten]
Ein alternatives Verfahren zur offenen konventionellen Operation ist die endovaskuläre Aneurysmatherapie (EAT oder EVAR für endovascular aneurysm bzw. aortic repair) durch Aneurysmaexklusion mittels Aortenstent. Dieser wird über die Femoralgefäße nach proximal in die Aorta platziert und so das Aneurysma ausgeschaltet. Seit der ersten EAT durch Parodi 1991 liegen Erfahrungen mit dieser wenig invasiven Methode bei mehreren tausend Patienten vor. Die publizierten Daten schwächen die anfängliche Euphorie für diese Methode ab. Es zeigt sich einerseits, dass die Platzierung bei einem Großteil der Patienten primär erfolgreich verläuft. Andererseits sind die Systeme keineswegs ausgereift, so dass im Mittel- und Langzeitverlauf die Komplikationsrate nicht unbeträchtlich ist.
Die endovaskulären Prothesensysteme bestehen aus einem selbstexpandierenden Nickel-Titan (= Nitinol)-Skelett, das von einer dünnwandigen Polyester- oder PTFE-Prothese überzogen ist. Dieses System wird auch Stentgraft, Hybridprothese oder gecoverter Stent genannt. Am gebräuchlichsten und in der elektiven Situation fast ausschließlich gebraucht sind modular aufgebaute Bifurkationsprothesen. Das Hauptmodul besteht aus dem Prothesenkörper, einem langen und einem zweiten kurzen Schenkel. Letzterer wird mit einem gesonderten kontralateralen Schenkel ergänzt. Beide Komponenten sind in getrennten Entladungssystemen verpackt. Sie werden über eine Inzision der Leistenarterie eingeführt, unter Röntgendurchleuchtung in das Aneurysma platziert und expandiert. Es sind auch aorto-uni-iliakale Systeme erhältlich, bei welchen die Blutversorgung des kontralateralen Beines über einen Crossover-Bypass erfolgt. Postinterventionell kann der Patient nach einem kurzen Aufenthalt auf der Überwachungsstation auf die Normalstation verlegt werden. Die Entlassung erfolgt nach Kontrolle bezüglich Endoleak (Duplexsonografie und CT) ca. vier Tage nach der Operation. Im Gegensatz zur offenen Operation, bei welcher kaum Nachkontrollen nötig sind, liegt das große Problem der Endoprothesen in der Entwicklung von so genannten Endoleaks (Leckage), die in bis zu 44 % der Fälle auftreten. Durch Endoleaks kommt der Aneurysmasack wieder unter systemischen Blutdruck, so dass das Ziel der Operation nicht erreicht ist. Folgende Endoleaktypen werden unterschieden:[2]
- Typ I wird durch eine undichte proximale oder distale Andockstelle verursacht. Es sollte so bald wie möglich endovaskulär mittels Verlängerung des Stents nach proximal oder offen operativ korrigiert werden.
- Endoleaks vom Typ II sind Folge eines retrograden Flusses von aortalen Seitenästen (Lumbalarterien/AMI). Sie kommen bei bis zu 40 % vor und können durch selektive Embolisation angegangen werden, verschließen sich jedoch in ca. 50 % spontan. Obwohl Aneurysmarupturen wegen Typ-II-Endoleaks beschrieben sind, scheinen sie das Rupturrisiko in größeren Serien innerhalb von zwei bis drei Jahren nicht zu beeinflussen.
- Typ-III-Endoleaks werden durch Graftdefekte oder Diskonnektion der Module verursacht. Ihnen wird eine Erhöhung des Rupturrisikos zugeschrieben; eine sofortige Sanierung ist empfehlenswert.
- Typ IV ist selten und beruht auf der Porosität des Grafts. Nach heutigem Wissen können auch nach einigen Jahren noch Endoleaks auftreten, die behandlungsbedürftig sind. Aus diesem Grund ist eine mindestens jährliche Nachkontrolle mittels Duplexsonografie, MRT oder CT notwendig. Die Langzeitresultate dieses Verfahrens sind noch völlig unbekannt.
Unter „Endotension“ wird die Situation verstanden, bei der sich ein ausgeschlossenes AAA weiter vergrößert, ohne dass ein Endoleak im CT oder sonografisch nachgewiesen werden kann. Andere Autoren bezeichnen dies auch als Endoleak Typ 5.[1]
Thorakoabdominales Aortenaneurysma
[Bearbeiten | Quelltext bearbeiten]Hier werden vier Typen unterschieden: Typ I umfasst den größten Teil der absteigenden Aorta und der oberen Bauchaorta, Typ II den größten Teil der aufsteigenden Aorta und der Bauchaorta, Typ III den distalen Teil der absteigenden Aorta und variierende Abschnitte der Bauchaorta und Typ IV den größten Teil der Bauchaorta oder die ganze Bauchaorta. Ursächlich können degenerative Aortenerkrankungen, angeborene Erkrankungen wie das Marfan-Syndrom oder eine chronische Aortendissektion sein.[3]
Thorakales Aortenaneurysma
[Bearbeiten | Quelltext bearbeiten]Die chirurgische Behandlungsbedürftigkeit eines thorakalen Aortenaneurysmas (Aneurysma verum aortae thoracicae) hängt von der Zunahme des normalen Durchmessers von über 50 % ab, besonders beim Kind. Die kritische Größe bei Erwachsenen ist bei einem Durchmesser von 50 bis 55 mm erreicht. Dafür stehen folgende Operationsverfahren zur Verfügung:
- Getrennt prothetischer Ersatz der Aortenklappe durch eine Kunstklappe oder eine gerüstmontierte biologische Prothese (Homograft = menschliche Spenderklappe) und Ersatz der Aorta ascendens durch eine Gefäßprothese. Diese Technik hat für gut selektierte Patienten (typischerweise der ältere Mensch) mit einer ausschließlichen Erweiterung der tubulären Aorta weiterhin ihre Berechtigung. Eine degenerative Erkrankung muss ausgeschlossen sein.
- Thorakale endovaskuläre Aortenreparatur (TEVAR): endovaskuläres Einsetzen einer Gefäßprothese
- Bei Hinweisen auf eine primäre Aortenwanderkrankung (Marfan-Syndrom), eine Mediannekrose oder bicuspide (zweizipflige) Aortenklappe wird ein simultaner Ersatz der gesamten Aortenwurzel durchgeführt. Diese Operation mit Gefäßprothese mit integrierter Klappenprothese (klappentragendes Conduit) wurde 1968 von Bentall und DeBono zuerst beschrieben. Diese Operation wird auch heute noch durchgeführt. Sie bedingt die lebenslange Einnahme gerinnungshemmender Medikamente (Cumarine). Wo immer möglich, ist heute die Kunstprothese zu vermeiden und klappenerhaltende Techniken mit biologischen Conduits werden bevorzugt. In diesen Fällen wird über die Durchführung der Ross-Operation zu entscheiden sein.
Unbehandelte Aortenaneurysmen können einreißen bzw. zu einer Dissektion (Aortendissektion) führen, was häufig zum Tod führt.
Aortendissektion
[Bearbeiten | Quelltext bearbeiten]
(histologisches Präparat)
Als Aortendissektion beziehungsweise Aneurysma dissecans aortae bezeichnet man die Aufspaltung der Wandschichten der Aorta, meist verursacht durch einen Einriss der inneren Gefäßwand (Tunica intima) mit nachfolgender Einblutung zwischen die Schichten. Sie verursacht in aller Regel plötzliche, heftige Schmerzen und ist unmittelbar lebensbedrohlich, weil sie zu einem Aufplatzen der Hauptschlagader (Aortenruptur) und zu akuten Durchblutungsstörungen verschiedener Organe führen kann. Während sie noch vor 50 Jahren meist tödlich endete, überlebt heute die Mehrzahl der Betroffenen. Dies ist hauptsächlich einer möglichst rasch eingeleiteten Operation der gefährlichen Formen zu verdanken, eine unverzügliche Diagnostik ist deshalb bei dieser Krankheit von entscheidender Bedeutung.
Literatur
[Bearbeiten | Quelltext bearbeiten]- S2-Leitlinie: Stumpfe Aortenverletzung und traumatisches Aortenaneurysma. AWMF-Registernummer 004/016, Stand 09/2008
- Innere Medizin. 2. vollständig überarbeitete und erweiterte Auflage. Thieme Verlag, Stuttgart 2009, ISBN 978-3-13-118162-6.
- Wolfgang Piper: Innere Medizin. Springer, Heidelberg 2007, ISBN 978-3-540-33725-6.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Lehrvideo: Messung der Aorta im Herzultraschall. 123sonography.com
- Artikel. Klinikum Konstanz.
- Qualitätssicherungs-Richtlinie zum Bauchaortenaneurysma: Konkretisierung der strukturellen Anforderungen. Gemeinsamer Bundesausschuss (G-BA).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Leitlinien zum Bauchaortenaneurysma und Beckenarterienaneurysma der Deutschen Gesellschaft für Gefäßchirurgie, S. 10. (PDF; 160 kB) 31. August 2008, archiviert vom (nicht mehr online verfügbar) am 18. April 2013; abgerufen am 18. September 2013. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Johannes Frömke: Standardoperationen in der Gefäßchirurgie. Steinkopff, Darmstadt 2006, ISBN 3-7985-1460-7, S. 130 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. 5. Auflage. Springer, Berlin / Heidelberg / New York u. a. 1999, ISBN 3-540-65024-5, S. 422 f. (1. Auflage 1986).