Epitop
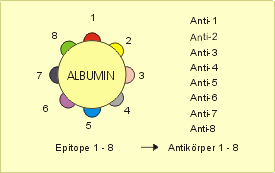
Ein Epitop (griech. ἐπί epi „bei, auf“ und τόπος topos „Ort“, synonym: antigene Determinante) ist eine Struktur, gegen die im Zuge einer adaptiven Immunantwort Antikörper oder T-Zell-Rezeptoren gebildet werden. Genauer sind Epitope umschriebene molekulare Strukturen bzw. Molekülabschnitte eines Antigens, die eine erworbene Immunantwort auslösen können.
Oftmals ist es ein Bereich der Oberfläche eines Antigens, an den ein Antikörper oder T-Zell-Rezeptor spezifisch bindet. Antikörper sind normalerweise gegen Proteine bzw. Proteide gerichtet. In seltenen Fällen können auch Antikörper gegen andere chemische Strukturen (z. B. DNA, Saccharide, Schwermetalle, Steroidhormone, Penicillin) gebildet werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ein einzelnes Antigen, wie z. B. ein Membranprotein einer Zelle oder eines Bakteriums, trägt verschiedene räumliche Epitope. Gegen jedes dieser Epitope kann ein spezifischer Antikörper oder eine spezifische T-Zelle gebildet werden. Epitope können art- bzw. individualspezifisch sein. Nach der Phagozytose der Antigene durch Antigen-präsentierende Zellen präsentieren diese die Epitope auf ihrer Zelloberfläche. Anschließend erfolgt die Adaptive Immunantwort.
Typischerweise besitzen Epitope, welche an MHC-Klasse-I-Moleküle gebunden sind, eine Länge von 8 bis 11 Aminosäuren, wohingegen MHC-Klasse-II-Epitope längere Peptidketten von 9 bis 18 Aminosäuren aufweisen.
Es wird bei Epitopen von Antikörpern zwischen kontinuierlichen (synonym Sequenzepitope) und diskontinuierlichen Epitopen (synonym Konformationsepitope) unterschieden. Proteine bestehen aus Aminosäureketten und sind dreidimensional gefaltet. So können Epitope aus verschiedenen, im Raum nah beieinander liegenden Aminosäureresten bestehen, die aber in der Aminosäuresequenz eigentlich weit voneinander entfernt sind. Solche Epitope werden diskontinuierlich genannt, da sie nur im nativen Zustand des Proteins vorhanden sind und erkannt werden können. Bei einer SDS-Gelelektrophorese und anschließendem Western Blot zum Beispiel werden die Aminosäureketten entfaltet (Denaturierung) und die Antikörper binden nicht mehr an diskontinuierliche Epitope, wenn die Epitope sich nicht erneut in die korrekte, native Form falten konnten. Kontinuierliche Epitope bleiben dagegen auch nach einer Denaturierung bestehen, da sie aus einer Sequenz aufeinanderfolgender Aminosäuren bestehen, welche bei der Denaturierung erhalten bleibt. Ein kontinuierliches Epitop eines Antikörpers besteht aus bis zu sechs Aminosäuren.[1] Darüber hinaus können posttranslationale Modifikationen Epitope maskieren und neue erzeugen.[1]
Die Bindungsspezifität von einem Antikörper an sein Epitop wird als Affinität, die Summe der Bindungsenergien aller an ein Antigen (mit mehreren Epitopen) bindenden Antikörper wird dagegen als Avidität bezeichnet. Die an der Bindungsstelle dem Epitop gegenüberliegende Fläche auf dem gebundenen Antikörper oder T-Zell-Rezeptor wird als Paratop bezeichnet. Die immundominanten Epitope erzeugen eine stärkere Immunantwort.
Anwendung
[Bearbeiten | Quelltext bearbeiten]Die systematische Untersuchung der Epitope in einem Antigen wird als Epitopkartierung bezeichnet. In der Biochemie finden Epitope tags Anwendung (z. B. His-Tag, Myc-tag, Strep-Tag, V5-Tag oder Flash-tag), um als Fusionsprotein den Nachweis von Proteinen zu ermöglichen, für die kein geeigneter Antikörper zur Verfügung steht. Hierzu wird in dasselbe Leseraster wie das zu untersuchende Protein das Gen eines Epitops eingebaut, sodass das exprimierte Protein ein N- oder C-terminales Epitope tag erhält. Gegen das angehängte Epitop kann nun ein Antikörper zur Detektion eingesetzt werden. Das gleiche Epitop kann in verschiedenen Versuchen immer wieder an neue Proteine angehängt werden, und somit kann auch immer der gleiche Antikörper verwendet werden, was eine erhebliche Aufwands- und Kosteneinsparung darstellt.
Die Immune Epitope Database ist eine Online-Datenbank für bereits beschriebene Epitope, daneben werden im Zuge der reversen Immunologie auch Programme zur Vorhersage der Bindungsaffinität von Epitopen an MHC-Moleküle angeboten (IEDB, SYFPEITHI).
Literatur
[Bearbeiten | Quelltext bearbeiten]- Charles A. Janeway et al.: Immunobiology: the immune system in health and disease. 6. Auflage, Garland Science, New York ISBN 0-8153-4101-6 (5. englische Ausgabe; Volltext online – NCBI-Bookshelf).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Meine Moleküle - Deine Moleküle. Von der molekularen Individualität - Jürgen Groth: Antigene – Antikörper. Das universelle Schlüssel-Schloß-Prinzip. (Online-Buch 2013) Auf: meine-molekuele.de; zuletzt abgerufen am 6. März 2022.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Abdul K. Abbas, Andrew Lichtman, Shiv Pillai: "Antibodies and Antigens". In: Cellular and Molecular Immunology, 9. Auflage, Elsevier 2018. ISBN 978-0-323-52324-0. Kapitel Antibody Binding of Antigens.