Erbium(III)-chlorid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
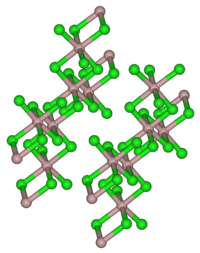
| ||||||||||
| _ Er3+ _ Cl− | ||||||||||
| Raumgruppe |
C2/m (Nr. 12) | |||||||||
| Allgemeines | ||||||||||
| Name | Erbium(III)-chlorid | |||||||||
| Andere Namen |
Erbiumtrichlorid | |||||||||
| Verhältnisformel | ErCl3 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 273,62 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Dichte |
4,1 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1500 °C[1] | |||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Erbium(III)-chlorid ist eine chemische Verbindung aus der Gruppe der Chloride.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Erbium(III)-chlorid kann durch Reaktion von Erbium(III)-oxid oder Erbium(III)-carbonat und Ammoniumchlorid gewonnen werden.[4]
Das Hexahydrat entsteht durch Reaktion von Erbium mit Salzsäure. Durch Reaktion mit Thionylchlorid kann dieses zur Anhydratform umgesetzt werden.[4]
Erbium(III)-chlorid kann auch direkt aus den Elementen Erbium und Chlor synthetisiert werden.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Erbium(III)-chlorid ist ein fast farbloser leicht rosaroter Feststoff. Sein Hexahydrat ist ein rosafarbener hygroskopischer Feststoff. Beide sind löslich in Wasser. Erbium(III)-chlorid besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12) entsprechend der von Aluminium(III)-chlorid. Das Hexahydrat besitzt ebenfalls eine monokline Kristallstruktur mit der Raumgruppe P2/n (Nr. 13, Stellung 2).[1] Erbium (III)-chlorid ist ein guter Katalysator für die Acylierung von Alkoholen und Phenolen.[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Erbium(III)-chlorid wird zur Herstellung von reinem Erbium verwendet.[7] Es kann auch als Ausgangsmaterial für neue kantenverbrückte oktaedrische M6-Cluster-Verbindungen wie CsErTa6Cl18 verwendet werden, für die Elektronen- und Stabilitätsstudien durchgeführt werden.[2]
Zudem kann es zur Synthese chloridischer Ionenleiter wie K2,6Er0,6Zr0,4Cl6 verwendet werden, welche für die Verwendung in Festkörperbatterien diskutiert werden.[8] Die Synthese erfolgt durch mechanochemische Umsetzung mit Kaliumchlorid und Zirconium(IV)-chlorid.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 2007, ISBN 978-3-540-60035-0, S. 444 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f g h Datenblatt Erbium(III) chloride, anhydrous, powder, 99.9% trace metals basis bei Sigma-Aldrich, abgerufen am 30. April 2012 (PDF).
- ↑ Datenblatt Erbium(III) chloride hexahydrate, 99.995% trace metals basis bei Sigma-Aldrich, abgerufen am 30. April 2012 (PDF).
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 897.
- ↑ Webelements: Erbium
- ↑ Renato Dalpozzo, Antonio De Nino, Loredana Maiuolo, Manuela Oliverio, Antonio Procopio, Beatrice Russo, Amedeo Tocci: Erbium(III) Chloride: a Very Active Acylation Catalyst, Australian Journal of Chemistry, 2006, 60(1), S. 75–79, doi:10.1071/CH06346.
- ↑ John Emsley: Nature's building blocks: an A-Z guide to the elements. Oxford University Press, 2003, ISBN 978-0-19-850340-8, S. 137 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Roman Schlem, Ananya Banik, Mirco Eckardt, Mirijam Zobel, Wolfgang G. Zeier: Na 3– x Er 1– x Zr x Cl 6 —A Halide-Based Fast Sodium-Ion Conductor with Vacancy-Driven Ionic Transport. In: ACS Applied Energy Materials. Band 3, Nr. 10, 26. Oktober 2020, S. 10164–10173, doi:10.1021/acsaem.0c01870.



