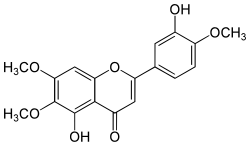
Eupatorin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Eupatorin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C18H16O7 | ||||||||||||||||||
| Kurzbeschreibung |
dunkelgelber Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 344,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Eupatorin ist eine chemische Verbindung aus der Gruppe der Flavone. Eupatorin kommt in verschiedenen Pflanzenarten des Tribus Eupatorieae vor, unter anderem in der Gattung Eupatorium (Eupatorium semiserratum,[2] Eupatorium altissimum), aber auch in Merrillia caloxylon,[3] Hyptis tomentosa,[4] Lantana montevidensis,[5] Centaurea arenaria,[6] Lippia dulcis,[7] Teucrium polium,[8] Salvia limbata,[9] Tanacetum vulgare[10] und Orthosiphon stamineus.[11]
Eupatorin beeinflusst die Mitose und führt zu Polyploidie und Apoptose.[12] Eupatorin besitzt in Säugetierzellen antiproliferative Wirkung gegen Tumorzellen und wird durch Cytochrom P1 abgebaut.[13] Gleichzeitig hemmt es Cytochrom P1[14] und STAT1α.[15] Eupatorin hemmt die Genexpression von iNOS und COX-2 und wirkt dadurch entzündungshemmend.[15]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Eupatorin, analytical standard bei Sigma-Aldrich, abgerufen am 8. März 2018 (PDF).
- ↑ S. M. Kupchan, J. R. Knox, M. S. Udayamurthy: Tumor inhibitors. 8. Eupatorin, new cytotoxic flavone from Eupatorium semiserratum. In: Journal of pharmaceutical sciences. Band 54, Nummer 6, Juni 1965, S. 929–930, PMID 5847037.
- ↑ J. H. Adams, J. R. Lewis: Eupatorin, a constituent of Merrillia caloxylon. In: Planta medica. Band 32, Nummer 1, August 1977, S. 86–87, doi:10.1055/s-0028-1097564, PMID 905420.
- ↑ D. G. Kingston, M. M. Rao, W. V. Zucker: Plant anticancer agents. IX. Constituents of Hyptis tomentosa. In: Journal of natural products. Band 42, Nummer 5, 1979 Sep-Oct, S. 496–499, PMID 521819.
- ↑ T. Nagao, F. Abe, J. Kinjo, H. Okabe: Antiproliferative constituents in plants 10. Flavones from the leaves of Lantana montevidensis Briq. and consideration of structure-activity relationship. In: Biological & pharmaceutical bulletin. Band 25, Nummer 7, Juli 2002, S. 875–879, PMID 12132661.
- ↑ B. Csapi, Z. Hajdú, I. Zupkó, A. Berényi, P. Forgo, P. Szabó, J. Hohmann: Bioactivity-guided isolation of antiproliferative compounds from Centaurea arenaria. In: Phytotherapy research : PTR. Band 24, Nummer 11, November 2010, S. 1664–1669, doi:10.1002/ptr.3187, PMID 21031625.
- ↑ M. Ono, H. Morinaga, C. Masuoka, T. Ikeda, M. Okawa, J. Kinjo, T. Nohara: New Bisabolane-Type Sesquiterpenes from the Aerial Parts of Lippia dulcis. In: Chemical & pharmaceutical bulletin. Band 53, Nummer 9, September 2005, S. 1175–1177, PMID 16141591.
- ↑ E. Verykokidou-Vitsaropoulou, C. Vajias: Methylated Flavones from Teucrium polium. In: Planta medica. Nummer 5, Oktober 1986, S. 401–402, doi:10.1055/s-2007-969198, PMID 17345353.
- ↑ A. R. Gohari, S. Saeidnia, M. Malmir, A. Hadjiakhoondi, Y. Ajani: Flavones and rosmarinic acid from Salvia limbata. In: Natural Product Research. Band 24, Nummer 20, Dezember 2010, S. 1902–1906, doi:10.1080/14786411003766912, PMID 21108116.
- ↑ G. R. Schinella, R. M. Giner, M. C. Recio, P. Mordujovich de Buschiazzo, J. L. Ríos, S. Máñez: Anti-inflammatory effects of South American Tanacetum vulgare. In: The Journal of pharmacy and pharmacology. Band 50, Nummer 9, September 1998, S. 1069–1074, PMID 9811170.
- ↑ Y. Tezuka, P. Stampoulis, A. H. Banskota, S. Awale, K. Q. Tran, I. Saiki, S. Kadota: Constituents of the Vietnamese medicinal plant Orthosiphon stamineus. In: Chemical & pharmaceutical bulletin. Band 48, Nummer 11, November 2000, S. 1711–1719, PMID 11086900.
- ↑ A. L. Salmela, J. Pouwels, A. Kukkonen-Macchi, S. Waris, P. Toivonen, K. Jaakkola, J. Mäki-Jouppila, L. Kallio, M. J. Kallio: The flavonoid eupatorin inactivates the mitotic checkpoint leading to polyploidy and apoptosis. In: Experimental cell research. Band 318, Nummer 5, März 2012, S. 578–592, doi:10.1016/j.yexcr.2011.12.014, PMID 22227008.
- ↑ V. Androutsopoulos, R. R. Arroo, J. F. Hall, S. Surichan, G. A. Potter: Antiproliferative and cytostatic effects of the natural product eupatorin on MDA-MB-468 human breast cancer cells due to CYP1-mediated metabolism. In: Breast cancer research : BCR. Band 10, Nummer 3, 2008, S. R39, doi:10.1186/bcr2090, PMID 18454852, PMC 2481486 (freier Volltext).
- ↑ V. P. Androutsopoulos, A. Papakyriakou, D. Vourloumis, D. A. Spandidos: Comparative CYP1A1 and CYP1B1 substrate and inhibitor profile of dietary flavonoids. In: Bioorganic & medicinal chemistry. Band 19, Nummer 9, Mai 2011, S. 2842–2849, doi:10.1016/j.bmc.2011.03.042, PMID 21482471.
- ↑ a b M. Laavola, R. Nieminen, M. F. Yam, A. Sadikun, M. Z. Asmawi, R. Basir, J. Welling, H. Vapaatalo, R. Korhonen, E. Moilanen: Flavonoids eupatorin and sinensetin present in Orthosiphon stamineus leaves inhibit inflammatory gene expression and STAT1 activation. In: Planta medica. Band 78, Nummer 8, Mai 2012, S. 779–786, doi:10.1055/s-0031-1298458, PMID 22516932.
