Thrombin
| Thrombin | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 70 Kilodalton / 622 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Heterodimer | |
| Kofaktor | Ca2+ | |
| Präkursor | Prothrombin; 579 AS | |
| Bezeichner | ||
| Gen-Namen | F2 ; PT | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | B02BC06 B02BD30 | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.21.5, Serinprotease | |
| MEROPS | S01.217 | |
| Reaktionsart | Hydrolyse | |
| Substrat | Fibrinogen | |
| Produkte | Fibrinopeptid A + Fibrinopeptid B + Fibrinvorstufe | |
| Vorkommen | ||
| Homologie-Familie | Thrombin | |
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2147 | 14061 |
| Ensembl | ENSG00000180210 | ENSMUSG00000027249 |
| UniProt | P00734 | P19221 |
| Refseq (mRNA) | NM_000506 | NM_010168 |
| Refseq (Protein) | NP_000497 | NP_034298 |
| Genlocus | Chr 11: 46.72 – 46.74 Mb | Chr 2: 91.63 – 91.64 Mb |
| PubMed-Suche | 2147 | 14061
|
Thrombin (Faktor IIa) ist das wichtigste Enzym der Blutgerinnung bei Wirbeltieren und einer der Blutgerinnungsfaktoren. Thrombin gehört zu den Serinproteasen und spaltet Fibrinogen zu Fibrin und den Fibrinopeptiden. Außerdem aktiviert es die Blutgerinnungsfaktoren V, VIII, XIII und, zusammen mit Thrombomodulin, das Protein C. Es hat Funktionen beim Entzündungsgeschehen und bei der Wundheilung. Der Precursor Prothrombin wird in der Leber gebildet und findet sich kontinuierlich im Blutplasma. Defekte im F2-Gen sind die Ursache für Dysprothrombinämie und können die Anfälligkeit für Schlaganfall erhöhen.[1]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Thrombin wurde erstmals 1892 von Schmidt in seinem Werk zur Blutlehre beschrieben:
„Die Faserstoffgerinnung hat eine Reihe von Umsetzungen im circulirenden Blute zu ihrer entfernteren Voraussetzung und besteht wesentlich (...) in drei aufeinander folgenden und voneinander abhängigen Akten und zwar:
- in der mit erhöhter Stärke sich fortsetzenden Abspaltung des Thrombins vom Prothrombin durch die zytoplastischen Substanzen.
- In der Wirkung des Thrombins, die in der Spaltung des Paraglobulins (fibrinoplastische Substanz) und der Überführung der aus dieser Spaltung hervor gehenden fibrinogenen Substanz in den flüssigen Faserstoff und
- in der Fällung des letzteren durch die Plasmasalze in unlöslicher Modifikation.“
1946 berichtete K. Lenggenhager und 1956 auch K. E. A. Schmidt, dass die Wunden bei Eingriffen nicht so stark bluten, wenn sie sich in Gegenwart von Thrombin befinden. H. Harnisch berichtete 1956 auch über die Verwendung in der Zahnheilkunde. In der weiteren Chirurgie wurde es ab den 1950ern genutzt.[2]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Prothrombin ist der Faktor II der Blutgerinnung. Es entsteht in der Leber und wird kontinuierlich ins Blut abgegeben. Prothrombin ist im Blutplasma nachweisbar. Im Blut finden sich nur geringe Spuren freien Thrombins, welches normalerweise erst bei Verletzung von Gewebe aus dem Prothrombin an Ort und Stelle gebildet wird. Eine Thrombinämie, das Vorkommen von freiem Thrombin und damit die Gerinnung von Blut in unverletzten Gefäßen, wird durch körpereigenes Antithrombin verhindert.
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Beim Menschen liegt das F2-Gen auf Chromosom 11 und erstreckt sich über 20.300 Basenpaare und 14 Exons. Nach der Transkription wird die 1.997 Basen lange mRNA in ein 622 Aminosäuren langes Protein translatiert und durch posttranslationale Modifikation entsteht Prothrombin mit 579 Aminosäuren.[3]
Biologische Funktion
[Bearbeiten | Quelltext bearbeiten]Die Wirkung von Thrombin beruht auf seiner Proteaseaktivität und betrifft zum einen die proteolytische Aktivierung von im Blutplasma gelösten Proteinen (Gerinnungsfaktoren und Fibrin) und zum anderen die Signalwirkung auf vaskuläre Zellen.
Die Verletzung eines Blutgefäßes löst im Blutplasma eine proteolytische Reaktionskaskade aus, an deren Ende die Freisetzung von Thrombin aus Prothrombin steht. Die FIIa-Generierung erfolgt im Prothrombinasekomplex (Gerinnungsfaktoren II, Va und Xa, über Calcium-Ionen möglicherweise mit membranären Phospholipiden assoziiert). Das freigesetzte Thrombin spaltet das im Blutplasma gelöst vorliegende Fibrinogen in Fibrin, welches sich zu unlöslichen Fibrin-Polymeren zusammenlagert. Zugleich fördert Thrombin die Aktivierung der Gerinnungsfaktoren V, VIII und XI und somit – über eine positive Feedback-Schleife – seine eigene Freisetzung.
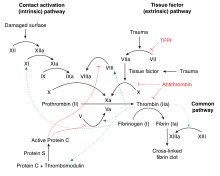
Neben der Wirkung von Thrombin auf Plasmaproteine steht seine Signalwirkung auf Zellen des vaskulären Systems. Die Mediation dieser Signalwirkung erfolgt über Protease-aktivierte Rezeptoren (PAR) auf der Oberfläche u. a. von Thrombozyten und Glattmuskelzellen. Bei Thrombozyten löst Thrombin die Thrombozytenaktivierung aus, bei vaskulären Glattmuskelzellen Proliferations- und Migrationsprozesse, die auch für atherosklerotische Prozesse von Bedeutung sind.[4]
Pharmakologie, Diagnose
[Bearbeiten | Quelltext bearbeiten]Thrombin kann durch zahlreiche Wirkstoffe gehemmt werden, z. B.:
- Antithrombin
- Heparin
- Niedermolekulare Heparine
- Pentasaccharid
- Orgaran
- Argatroban
- Hirudin
- Rhodniin
- Ornithodorin
- Dabigatranetexilat
- BC 007
Die Funktion des Thrombins kann man mittels verschiedener Gerinnungstests abschätzen: Prothrombinspiegel, Thromboplastinzeit (Quickwert), Partielle Thromboplastinzeit, Thrombingenerierungstest.
Anwendungen in der Nahrungsmittelindustrie
[Bearbeiten | Quelltext bearbeiten]Thrombin vom Hausschwein (Sus scrofa) wird von der Nahrungsmittelindustrie bei der Herstellung von Lebensmitteln, etwa Wurstwaren, eingesetzt. Eine Anwendung als Fleischkleber, um künstlich größere Fleischteile wie Schinken herzustellen, lehnte das Europäische Parlament im Mai 2010 mit knapper Mehrheit ab.[5][6][7]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- AXEL W. BAUER und KERSTIN MALL: HÄMOSTASE, THROMBOSE UND EMBOLIE - Historische Konzepte zur Physiologie und Pathologie der Blutgerinnung ( vom 19. Juni 2008 im Internet Archive)
- Schmidt: Zur Blutlehre. Leipzig, 1892
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ UniProt P00734
- ↑ Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarbeitete und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2005, ISBN 978-3-8047-2113-5, S. 116 f.
- ↑ ENSEMBL-Eintrag
- ↑ Stouffer GA, Runge MS: The role of secondary growth factor production in thrombin-induced proliferation of vascular smooth muscle cells. In: Semin. Thromb. Hemost. 24. Jahrgang, Nr. 2, 1998, S. 145–50, PMID 9579635.
- ↑ spiegel online: Industrie muss auf Klebefleisch verzichten (abgerufen am 19. Mai 2010).
- ↑ Europaparlament stoppt Fleischkleister. In: Süddeutsche Zeitung, 20. Mai 2010.
- ↑ European Parliament Press Release: MEPs veto "meat glue" authorisation.