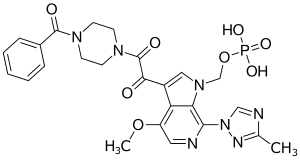
Fostemsavir
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Fostemsavir | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C25H26N7O8P | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 583,49 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Fostemsavir ist ein virostatisch wirksamer Arzneistoff. Er wurde unter dem Namen Rukobia (Pharmazeutischer Unternehmer: ViiV Healthcare) 2020 in den USA sowie 2021 in der EU[2] zur oralen Behandlung von HIV-Infektionen zugelassen.[3]
Hintergrund
[Bearbeiten | Quelltext bearbeiten]Eine HIV-Infektion gilt heute als eine als eine gut behandelbare, beherrschbare, lebenslange Erkrankung. Allerdings haben etwa 6 % der mit HIV lebenden Erwachsenen aufgrund von Resistenz-, Verträglichkeits- oder Sicherheitsüberlegungen kaum oder gar keine Möglichkeit auf eine Behandlung der HIV-Infektion. Diese Menschen waren bisher dem Risiko ausgesetzt, an AIDS zu erkranken und einen vorzeitigen Tod zu erleiden. Dieses Medikament könnte möglicherweise einem Teil dieser Menschen wieder ein normales Leben ermöglichen.[4]
Indikation
[Bearbeiten | Quelltext bearbeiten]Das HIV-Medikament soll in Kombination mit anderen antiretroviralen Medikamenten zur Behandlung von Erwachsenen mit multiresistenter HIV-1-Infektion eingesetzt werden, wenn aufgrund von Resistenzen, Unverträglichkeiten oder Sicherheitserwägungen kein supprimierendes antivirales Behandlungsregime zur Verfügung steht.[5][6]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Die häufigsten Nebenwirkungen, die bei mindestens 5 % der Studienteilnehmer beobachtet wurden, waren Übelkeit, Müdigkeit und Durchfall. Bei 3 % der Personen, die Fostemsavir einnahmen, traten schwerwiegende Arzneimittelreaktionen auf, darunter drei Fälle des schweren entzündlichen Immunrekonstitutionssyndroms (Immune Reconstitution Inflammatory Syndrome, IRIS),[6] einer schweren überschießenden Reaktion des Immunsystems.
Wirkungsmechanismus
[Bearbeiten | Quelltext bearbeiten]
Fostemsavir ist die Prodrug des Temsavir. Durch Hydrolyse entsteht die pharmakologisch wirksame Form. Temsavir blockiert das gp120, einen bestimmten Rezeptor auf der Oberfläche des Virus, so dass die anfängliche virale Bindung an die CD4 + T-Wirtszelle verhindert wird. Dadurch wird der Eintritt in die Immunzelle des Wirts unterbunden. Das Medikament greift an einem anderen Lebenszyklus-Schritt des Virus an, so dass der Wirkstoff ein Potenzial in der Behandlung von resistenten HI-Viren bietet.[7]
Entwicklung
[Bearbeiten | Quelltext bearbeiten]Ausgehend von der in einem Hochdurchsatz-Screening identifizierten den HIV-1-Eintrittsprozess störenden Struktur Indol-3-glyoxamid führten gezielte Optimierungen am Molekül zum Attachment-Inhibitor Temsavir. Dessen Phosphonooxymethylderivat Fostemsavir wurde entwickelt, um Resorptionseigenschaften und die resultierende Bioverfügbarkeit zu verbessern. Entwicklungshistorie und die Synthese sind in der Literatur beschrieben.[8] Pharmazeutisch eingesetzt wird der Wirkstoff als Fostemsavir-Trometamol.[9]
Die Zulassung von Rukobia in den USA beruht auf den Ergebnissen der BRIGHTE-Studie, die über 96 Wochen an 371 behandlungserfahrenen Probanden mit HIV-1-Resistenz durchgeführt wurde. Eingeschlossen wurden Patienten mit einer Viruslast von > 400 Kopien/ml und Therapiefehlschlag gegenüber verschiedenen antiretrovirale Wirkstoffklassen aufgrund von Resistenz, Unverträglichkeit, Kontraindikation oder anderen Sicherheitsbedenken (maximal 2 Klassen antiretroviraler Medikamente zu Studienbeginn verbleibend).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Rukobia. In: European Public Assemment Report (EPAR). Europäische Arzneimittelagentur, abgerufen am 9. Februar 2022.
- ↑ Novel Drug Approvals for 2020. FDA (englisch).
- ↑ ViiV Healthcare announces US FDA approval for Rukobia (fostemsavir), a first-in-class treatment for HIV in adults with few treatment options available. 2. Juli 2020, abgerufen am 25. Juli 2020 (englisch).
- ↑ Fostemsavir. Auf der Website von HIV&more online. 30. Januar 2020, abgerufen am 25. Juli 2020.
- ↑ a b Rukobia - fostemsavir tromethamine tablet, film coated, extended release. DailyMed (englisch).
- ↑ A. Negt: ViiV: Zulassungsantrag für Fostemsavir eingereicht. Apotheke adhoc. 30. Januar 2020, abgerufen am 25. Juli 2020.
- ↑ N. A. Meanwell et al.: Inhibitors of HIV-1 Attachment: The Discovery and Development of Temsavir and its Prodrug Fostemsavir. In: Journal of Medicinal Chemistry. Band 61, 2018, S. 62–80, doi:10.1021/acs.jmedchem.7b01337.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Fostemsavir-Trometamol: CAS-Nr.: 864953-39-9, EG-Nr.: 682-137-1, ECHA-InfoCard: 100.207.286, PubChem: 46892186, ChemSpider: 28637754, Wikidata: Q27255740. {3-[(4-Benzoylpiperazin-1-yl)-oxoacetyl]-4-methoxy-7-(3-methyl-1H-1,2,4-triazol-1-yl)-1H-pyrrolo[2,3-c]pyridin-1-yl}methyldihydrogenphosphat-2-Amino-2-(hydroxymethyl)propan-1,3-diol-Salz (1:1). C25H26N7O8P·C4H11NO3, Molmasse: 704,6 g·mol−1. Codes: BMS-663068-03, GSK3684934A