Generationswechsel
Als Generationswechsel bezeichnet man in der Biologie eine Form der Fortpflanzung, bei der die beiden Varianten der Fortpflanzung – die geschlechtliche und die ungeschlechtliche – in verschiedenen Generationen abwechselnd auftreten. Generationswechsel tritt bei vielen Protisten, bei Rotalgen, Moosen, Farnen und Samenpflanzen, aber auch bei Nesseltieren und Tunicaten auf. Er kombiniert die Vorteile beider Fortpflanzungsarten: Die sich ungeschlechtlich vermehrende Generation kann eine große Anzahl von Nachkommen erzeugen, ohne dafür einen Sexualpartner zu benötigen. Die sich geschlechtlich vermehrende Generation sorgt für eine Durchmischung des Genpools.
Variationen des Generationswechsels
[Bearbeiten | Quelltext bearbeiten]Die Generationen können sich sowohl in ihrer genetischen Ausstattung (der Zahl ihrer Chromosomen infolge eines Kernphasenwechsels) als auch in ihrem äußeren Erscheinungsbild voneinander unterscheiden. In der Regel sind Generationswechsel zweigliedrig, also aus zwei voneinander verschiedenen Generationen zusammengesetzt, es kommen aber auch mehrgliedrige mit mehr als nur zwei unterschiedlichen Generationen vor:
Heterophasischer Generationswechsel
[Bearbeiten | Quelltext bearbeiten]Beim heterophasischen Generationswechsel wechseln sich haploide und diploide Generationen ab (Kernphasenwechsel). Der Übergang von der haploiden zur diploiden Phase erfolgt durch die Vereinigung zweier Zellkerne unterschiedlicher Herkunft (Karyogamie), die in der Regel nach der Vereinigung zweier Gameten (Geschlechtszellen) stattfindet. Dieser Vorgang wird als Befruchtung bezeichnet. Der Übergang von der diploiden zur haploiden Phase ist die Meiose oder Reduktionsteilung. Lebewesen mit einem heterophasischen Generationswechsel werden als Diplohaplonten bezeichnet (Näheres siehe dort).
Beispiele:
- Farne produzieren (häufig auf der Unterseite der Farnwedel) auf ungeschlechtliche Weise Milliarden von Sporen, die zu einem nur einige Millimeter großen Prothallium heranwachsen. Erst diese Generation, die der Laie kaum wahrnimmt, vermehrt sich geschlechtlich und erzeugt wiederum die allbekannte „normale Farnpflanze“. Farne besitzen also einen heteromorphen und heterophasischen Generationswechsel.
- Siehe auch Sporophyt und Gametophyt sowie (für Rotalgen) Tetrasporophyt.
- Moose sind im Gegensatz zu Farnen dadurch charakterisiert, dass die jedem bekannte „normale Moospflanze“ keine Sporen produziert, sondern Gameten (Geschlechtszellen). Die Sporen erzeugende Generation ist meist nur ein niedriger, haarförmiger Ständer mit Sporenkapsel, der auf der „Moospflanze“ wächst. Auch die Moose besitzen somit einen heteromorphen und heterophasischen Generationswechsel.
- Plasmodien, die Erreger der Malaria, verursachen aufgrund ihrer Fähigkeit zur asexuellen Vermehrung (Teilung) die krankheitstypischen Fieberschübe, besitzen im Wechsel mit dieser Generation aber auch eine sexuell aktive Generation.
Homophasischer Generationswechsel
[Bearbeiten | Quelltext bearbeiten]Es gibt keinen Wechsel des Ploidiegrads. Diese Variante kommt bei mehrgliedrigen Generationswechseln vor.
Es kann unterschieden werden zwischen einem haplohomophasischen (alle Formen haploid, außer den Zygoten) und einem diplohomophasischen (alle Formen diploid, außer den Gameten) Generationswechsel.
Metagenese
[Bearbeiten | Quelltext bearbeiten]Metagenetischer Generationswechsel ist ein homophasischer Generationswechsel, der ausschließlich bei verschiedenen Gruppen der Metazoa (vielzelligen Tiere) auftritt. Immer abwechselnd folgt einer Generation mit zweigeschlechtlicher Fortpflanzung eine Generation mit ungeschlechtlicher Fortpflanzung, der wiederum eine Generation mit geschlechtlicher Fortpflanzung folgt.[1][2]
Beispiele:
- Quallen produzieren Geschlechtszellen, nach deren Verschmelzung aus der Zygote eine Larve (Planulalarve) entsteht. Diese Larve setzt sich am Boden fest und wächst zu einem Polyp aus. Von ihm schnüren sich wieder diverse Quallen ab. Dieser Generationswechsel ist heteromorph und homophasisch diploid.
- Bandwürmer sind meist protandrische Zwitter (zum Teil mit Selbstbefruchtung) im Endwirt, selten können jedoch die Finnen sich durch Knospung im Zwischenwirt vermehren.
- Trematoda (Saugwürmer) sind durchweg parasitische Metazoa und zeigen einen obligatorischen Wirts- und Generationswechsel. Beispielhaft zu nennen sind hier: Kleiner Leberegel (Dicrocoelium dendriticum) sowie Pärchenegel (Schistosoma mansoni, der Erreger der Bilharziose).
Anisomorpher bzw. heteromorpher Generationswechsel
[Bearbeiten | Quelltext bearbeiten]Die Generationen unterscheiden sich in ihrem äußeren Aussehen.
Beispiele:
Isomorpher Generationswechsel
[Bearbeiten | Quelltext bearbeiten]Die Generationen sind äußerlich nicht unterscheidbar.
Beispiel:
- Ulva lactuca, der Meersalat
Heterogonie
[Bearbeiten | Quelltext bearbeiten]Heterogoner Generationswechsel: Eine oder mehrere Generationen, die sich parthenogenetisch fortpflanzen, folgen auf eine Generation mit sexueller Fortpflanzung.
Beispiele:
- Blattläuse können sich bei günstiger Witterung im Frühjahr extrem rasch vermehren, weil dies bei den meisten Arten über mehrere Generationen hinweg mittels Parthenogenese geschieht. Erst bei ungünstigeren Umweltbedingungen bildet sich wieder eine geflügelte, sich geschlechtlich fortpflanzende Generation, die zugleich auch die Verbreitungsform darstellt und in der Lage ist, weite Strecken zu neuen Wirtspflanzen fliegend zu überwinden.
- Zwergfadenwürmer des Menschen verfügen über einen Generationswechsel zwischen parthenogenetischem Weibchen (als Parasit) und einer freilebenden zweigeschlechtlichen Generation.
- Weitere Beispiele sind Wasserflöhe, Gallwespen und Gallmücken.
Der Generationswechsel in der Stammesgeschichte der Pflanzen
[Bearbeiten | Quelltext bearbeiten]Die Stammesgeschichte der Pflanzen – der Übergang von Süßwasser-Grünalgen zu Moosen und Farnen sowie später zu den Ginkgopflanzen, den Nadelholzgewächsen und den Blütenpflanzen – wird besonders gut nachvollziehbar, wenn sie im Licht jener Konsequenzen betrachtet wird, die eine bestimmte Form des Generationswechsels zur Folge hat.
Alle Eukaryoten, die sich sexuell fortpflanzen, meistern im Laufe ihres Lebens eine haploide und eine diploide Phase, hervorgerufen durch Meiose (Haploidie) und Befruchtung (Diploidie). Für die an Land lebenden Pflanzen ergab die Rekonstruktion ihrer Stammesgeschichte, dass sich ihr Lebenszyklus von einer ursprünglichen Dominanz des freilebend-haploiden Gametophyten hin zu einer Dominanz des freilebend-diploiden Sporophyten entwickelte.[3] Dieser evolutive Trend bewirkte insbesondere, dass die Landpflanzen mittels Meiose und damit einhergehender inter- und intrachromosomaler Rekombination sowie nachfolgender Befruchtung ein größeres Maß an genetischer Vielfalt erzeugen konnten als die ursprünglicheren Eukaryoten.
Als engste heute noch lebende Verwandte der Urahnen aller Landpflanzen gelten aktuell die Armleuchteralgen (Charophyceae oder Charales).[4] Bei ihnen gibt es keinen Generationswechsel, denn mit Ausnahme der diploiden Zygote sind Armleuchteralgen haploid (Haplonten). Die Landbesiedelung wird jedoch alternativ auch auf frühe Arten der Schmuckalgen aus der Gruppe der Streptophyta zurückgeführt.[5] Aus dem Lebenszyklus der rezenten Lebermoose wiederum kann hergeleitet werden, warum sich bei den Landpflanzen die dominierende diploide Generation herausbildete.
Ursprünge
[Bearbeiten | Quelltext bearbeiten]Aus der Beobachtung, dass alle Prokaryoten haploid sind, wird abgeleitet, dass die frühesten Lebewesen haploid waren und Haploidie mehr als eine Milliarde Jahre die einzige Lebensform auf der Erde war.[6] Vorteilhaft ist Haploidie insofern, als Mutationen, die für die Vermehrung schädlich sind, umgehend aus dem Genpool verschwinden, da sie nicht durch ein Allel maskiert werden können. Umgekehrt gilt die Diploidie als vorteilhaft, gerade weil rezessive Allele – die in Zukunft, unter veränderten Umweltbedingungen, vorteilhaft sein könnten – maskiert werden und im Genpool erhalten bleiben. Zudem steigt bei vielzelligen Organismen, in denen zahlreiche mitotische Teilungen stattfinden, die Wahrscheinlichkeit für das Aufkommen potentiell schädlicher Mutationen in einzelnen Zellen oder Zell-Linien, was jedoch aufgrund der existierenden Allele kompensiert werden kann – eine Annahme, die insbesondere auch auf Landpflanzen zutrifft, denn sie sind im Vergleich mit wasserlebenden Pflanzen einer wesentlich erhöhten Ultraviolettstrahlung ausgesetzt.[7]
Eukaryoten existieren seit rund zwei Milliarden Jahren[8] und haben in dieser Zeitspanne nicht nur eine Vielfalt an Fortpflanzungsvarianten entwickelt, sondern auch eine große Vielfalt an physiologischen und morphologischen Varianten. Unter den sogenannten Protisten gibt es beispielsweise Arten wie die Grünalge Chlamydomonas reinhardtii, deren beide Phasen einzellig und freilebend sind. Die haploide Phase der Armleuchteralge Chara vulgaris ist hingegen vielzellig und kann mehrere Dutzend Zentimeter lang werden, während die diploide Phase aus einer einzelligen Zygote besteht. Bei Selaginella denticulata aus der Gattung der Moosfarne wiederum sind beide Phasen vielzellig. Und schließlich gibt es zahlreiche abgeleitete Eukaryoten, bei denen die diploide Phase vielzellig ist und die haploide Phase nur in Form von einzelligen Gameten existiert (zum Beispiel bei allen Säugetieren).
Obwohl schon in der zweiten Hälfte des 19. Jahrhunderts Grünalgen der Gattung Coleochaete als Modell für das Entstehen der Landpflanzen herangezogen wurden, bestätigten erst in den 1970er- und 1980er-Jahren genaue Vergleiche morphologischer Merkmale von Algen und Landpflanzen die enge stammesgeschichtliche Verwandtschaft der unter der Bezeichnung Charophyta zusammengefassten Gattungen, insbesondere jene der Streptophyta. Als relativ ursprünglich gelten neben den Armleuchteralgen u. a. auch die rezenten Gattungen Mesostigma, Chlorokybus und Klebsormidium. Zudem bestätigten genetische Analysen die ebenfalls schon im 19. Jahrhundert formulierte Vermutung, dass Laubmoose, Bärlapppflanzen, Farne und Samenpflanzen auf einen gemeinsamen Vorfahren zurückzuführen sind.[9] Von einem dieser frühen Verwandten der heutigen Armleuchteralgen ging die Entwicklungslinie nach heutigem Wissenstand über frühe Verwandte der heutigen Laubmoose zu urzeitlichen Gefäßsporenpflanzen und schließlich zu den Samenpflanzen.
Der Generationswechsel bei den Moosen
[Bearbeiten | Quelltext bearbeiten]
Die heute lebenden Moose produzieren in ihren männlichen Geschlechtsorganen (den Antheridien) – wie die Grünalgen – begeißelte Geschlechtszellen (Spermatozoide). Diese müssen sich in tropfbar-flüssigem Wasser zu den Eizellen bewegen, die in den weiblichen Geschlechtsorganen (den Archegonien) festsitzen. Im Unterschied zu den Armleuchteralgen folgt bei ihnen aber auf die Befruchtung nicht unmittelbar die Meiose und damit die Rückkehr zur haploiden Phase, sondern es wird ein diploides Sporogon ausgebildet, das schließlich Sporen hervorbringt. Diese diploide Generation, die auf der Mutterpflanze sitzt, wird deshalb als Sporophyt bezeichnet, die haploide Mutterpflanze als Gametophyt. Dabei ist der Sporophyt meist wesentlich kleiner als der Gametophyt. Moose sind Spezialisten für feuchte Standorte, weil der Gametophyt (wie auch die Algen) im Unterschied zum Sporophyten keinen Verdunstungsschutz in Form einer Cuticula hat. Die Entwicklung hin zu einem dominierenden Gametophyten hat laut Walter Zimmermann[10] den Moosen bislang zudem jeden Weg zu wirklich großwüchsigen Arten abgeschnitten, da ihren Spermatozoiden nur in Bodennähe der Weg von einer Pflanze zur Nachbarpflanze gelingen kann.
Es wird vermutet, dass Laubmoose vor dem Aufkommen der Gefäßpflanzen für rund 100 Millionen Jahre die vorherrschende Vegetationsform an Land waren.[6]
Der Generationswechsel bei den Farnen
[Bearbeiten | Quelltext bearbeiten]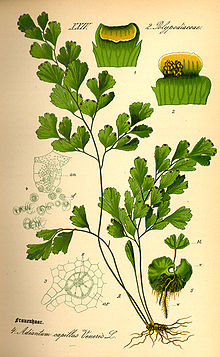

Auch Farne produzieren begeißelte Geschlechtszellen (Spermatozoide), die ihren Weg zu den weiblichen Geschlechtsorganen in einer Flüssigkeit zurücklegen müssen. Anders als bei den Moosen ist aber bei den Farnen der Sporophyt (die Sporen produzierende Generation) in seiner Größe vorherrschend geworden. Dies eröffnete den Farnen alle Möglichkeiten zum Größenwachstum, bis hin zu 30 Meter hohen Baumfarnen. Der Gametophyt (die Geschlechtszellen produzierende Generation) hingegen blieb bei den Farnen – ähnlich wie bei den Moosen – erdverbunden und ähnelt tatsächlich bei vielen Farnarten einem Lebermoos (Einzelheiten hierzu siehe unter Prothallium).
Der Sexualakt wird unabhängig von freiem Wasser
[Bearbeiten | Quelltext bearbeiten]1896 entdeckte ein japanischer Forscher, dass Ginkgo-Bäume begeißelte Geschlechtszellen (Spermatozoide) entwickeln; wenig später wurde das gleiche Phänomen auch beim Japanischen Palmfarn (Cycas revoluta) nachgewiesen. Beide Pflanzen können daher als lebendes Fossil eingestuft werden und als Beleg für die biologische Evolution, für den Übergang von Spermienbefruchtung zur Samen-Bildung.
Ginkgo
[Bearbeiten | Quelltext bearbeiten]Der Ginkgo ist eine zweihäusige Pflanze, es gibt also männliche und weibliche Individuen. Im noch immer existenten Generationswechsel entspricht der Ginkgobaum dem Sporophyt der Farne und Moose. Allerdings werden die Sporen der weiblichen Pflanzen nicht mehr in die Luft freigesetzt, sie sind vielmehr gleichsam im Sporangium sesshaft geworden und relativ groß (genannt Megasporen; Megasporen gibt es auch bei diversen Algen). Überdies erhalten die Megasporen von den Ginkgopflanzen, die sie bilden, so viel Nahrung zugeteilt, dass sie später ohne selbständige Ernährung Geschlechtszellen entwickeln können. Die Sporen der männlichen Pflanzen (genannt Mikrosporen oder Pollen) erfahren noch im „Mikrosporangium“ (der Anthere) ihre ersten mitotischen Teilungen und werden so zum Mikrogametophyten und als solche über den Wind verbreitet. Der Ginkgo-Baum (also der Sporophyt) scheidet das für die Fortbewegung der männlichen Geschlechtszellen nötige Wasser an der Mikropyle der Samenanlage selbst aus (Pollinations-Tröpfchen). Der erst nach Ankunft bei der weiblichen Pflanze wachsende Pollenschlauch (bei Ginkgo dient er vor allem als Haftorgan) ist nichts anderes als das Rudiment eines einstmals selbständig wachsenden Gametophyten. Die Geschlechtsgeneration (der Gametophyt) ist bei Ginkgo (und bei allen anderen Samenpflanzen) also extrem reduziert.
Phylogenetisch formuliert kann man also sagen: Im Inneren der Megaspore (Embryosackmutterzelle) entwickelt sich ein extrem reduzierter Megagametophyt (befruchtungsfähiger Embryosack), der über sein Megagametangium (Synergiden) einen Megagameten (Eizelle) erzeugt. Die Mikrospore wird als stark reduzierter Mikrogametophyt (mehrzelliges Pollenkorn) vom Wind zum Megagametophyten geweht, wo sie auskeimt, Mikrogameten (Spermatozoide) entlässt und damit den Megagameten befruchtet.
Bedecktsamer
[Bearbeiten | Quelltext bearbeiten]

Die stetige Verkleinerung des Gametophyten und schließlich die Einverleibung des weiblichen Gametophyten in seinen „Mutter-Sporophyten“ führte letztlich zur vollständigen Unabhängigkeit des Sexualaktes von tropfbar-flüssigem Wasser und perfektioniert so die Anpassung der Pflanzen an das Landleben: Dies kann als wichtigster Grund dafür angesehen werden, dass Samenpflanzen heute die vorherrschende Lebensform unter den Landpflanzen sind.
Bei einigen Nacktsamern (bei Eiben und Zypressen) existieren zwar noch Pollinations-Tröpfchen, aber auch bei ihnen wächst der Pollenschlauch ins Innere der Megaspore hinein. So kann ein männlicher Zellkern (ein gleichsam aufs Wesentliche reduziertes Spermium) unmittelbar zur Eizelle vordringen. Bei den Bedecktsamern sind die Samenanlagen schließlich in ein Fruchtblatt-Gehäuse eingeschlossen, das die Ernährung der auskeimenden Samen (also der jugendlichen Sporophyten) ebenso optimiert wie ihre Verbreitung, beispielsweise durch Tiere oder den Wind. Der Pollen landet hier auf einer besonderen Struktur des Fruchtblattes, der Narbe.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Walter Zimmermann: Geschichte der Pflanzen. Eine Übersicht. 2. Auflage, München 1969, dtv Band 4043. (Die Abschnitte zu Moosen, Farnen, Ginkgo und Bedecktsamern folgen im Wesentlichen der Argumentation dieser Quelle.)
- Klaus Ulrich Leistikow und Franziska Kockel: Zur Entwicklungsgeschichte der Pflanzen – ein didaktisches Modell. In: Palmarum Hortus Francofortensis (Wissenschaftliche Berichte des Frankfurter Palmengartens), Heft 2, Frankfurt am Main, Juni 1990 (Inhaltsübersicht ( vom 19. Juli 2011 im Internet Archive))
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Lexikon der Biologie: Generationswechsel. Spektrum, Heidelberg 1999.
- Sexualität bei Ginkgo (englisch)
- Plants without Seeds: from Water to Land
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Metagenese. In: Lexikon der Biologie, Online-Ausgabe, 1999.
- ↑ Metagenese. In: Karlheinz Uhlenbrock: Fit fürs Abi. Biologie Oberstufenwissen. Georg Westermann Verlag, Online-Ausgabe, 2001.
- ↑ Yin‐Long Qiu, Alexander B. Taylor und Hilary A. McManus: Evolution of the life cycle in land plants. Review in: Journal of Systematics and Evolution. Band 50, Nr. 3, 2012, S. 171–194, doi: 10.1111/j.1759-6831.2012.00188.x, Volltext (PDF)
- ↑ Tomoaki Nishiyama, Hidetoshi Sakayama et al.: The Chara Genome: Secondary Complexity and Implications for Plant Terrestrialization. In: Cell. Band 174, Nr. 2, 2018, S. 448–464.e24, doi:10.1016/j.cell.2018.06.033
Feste Zellwand bereitete Landgang vor. Auf: idw-online.de vom 12. Juli 2018 - ↑ Jan de Vries, Bruce A. Curtis, Sven B. Gould und John M. Archibald: Embryophyte stress signaling evolved in the algal progenitors of land plants. In: PNAS. Band 115, Nr. 15, E3471–E3480, 2018, doi:10.1073/pnas.1719230115
- ↑ a b Yin‐Long Qiu et al., Evolution of the life cycle in land plants, S. 173
- ↑ Yin‐Long Qiu et al., Evolution of the life cycle in land plants, S. 174
- ↑ A.H. Knoll, E.J. Javaux, D. Hewitt und P. Cohen: Eukaryotic organisms in Proterozoic oceans. In: Philosophical Transactions of the Royal Society of London, Series B: Biological Sciences. Band 361, 2006, S. 1023–1038, doi:10.1098/rstb.2006.1843
- ↑ Yin‐Long Qiu et al., Evolution of the life cycle in land plants, S. 177
- ↑ Walter Zimmermann: Geschichte der Pflanzen. Eine Übersicht. 2. Auflage, München 1969, dtv Band 4043