Halohydrine


Halohydrine (auch Halogenhydrine) sind eine Substanzklasse organischer Verbindungen, die als funktionelle Gruppe an ein Kohlenstoff-Atom ein Halogen als Substituenten und an einem benachbarten Kohlenstoff-Atom eine Hydroxygruppe tragen. Halohydrine ist damit die historische Bezeichnung für systematisch als 2-Halogen-1-alkanole zu benennende aliphatische Verbindungen, die sich von 1,2-Glykolen durch Ersatz einer Hydroxygruppe durch ein Halogen ableiten.[1] Die einfachsten Vertreter sind die 2-Haloethanole 2-Fluorethanol, 2-Chlorethanol, 2-Bromethanol und 2-Iodethanol.
Einige Quellen widersprechen jedoch dieser engen Definition, da einige Verbindungen ebenfalls als Halohydrin bezeichnet werden, aber das Halogen und die Hydroxygruppe nicht an benachbarten Kohlenstoffatomen tragen. Ein Beispiel ist die Verbindung 3-Chlor-1-propanol, die auch häufig Trimethylenchlorhydrin genannt wird.[2] Die IUPAC zum Beispiel gibt als Definition für Halohydrine an: Ein traditioneller Begriff für Alkohole, die durch ein Halogenatom an einem gesättigten Kohlenstoffatom substituiert sind, das ansonsten nur Wasserstoff- oder Kohlenwasserstoffgruppen trägt (in der Regel werden damit β-Halogenalkohole bezeichnet).[3]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Halohydrine werden in der Regel aus Olefinen durch Halogenierung in Anwesenheit von Wasser hergestellt. Meist werden dazu Hypohalogensäuren verwendet.[4] Iodhydrine und Fluorhydrine können aus den entsprechenden Chlor- oder Bromverbindungen durch Einwirkung von anorganischen Iodiden und Fluoriden gewonnen werden.[5] Als Halogenquelle dient hier häufig N-Bromsuccinimid (NBS) oder N-Chlorsuccinimid (NCS).[6] Ein weiteres Verfahren ist die Umsetzung von Epoxiden mit Halogenwasserstoff-Säuren. Für Chlor als Halogen existiert der Spezialfall der Chlorhydrinierung als Darstellungsmethode.[7][8]
In Anwesenheit einer Base entsteht das Halohydrin nur als Zwischenstufe und es findet eine intramolekulare Cyclisierung zum Epoxid statt. Dies ist die Umkehrung der Reaktion zur Darstellung von Halohydrinen aus Epoxiden mit Halogenwasserstoffsäuren.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Für die 2-Halogenethanole gibt es neun mögliche Rotationskonformere, die sich vor allem durch die Werte der XCCO- und/oder CCOH-Diederwinkel unterscheiden.[9]
Verwendung
[Bearbeiten | Quelltext bearbeiten]
trans-Halohydrine lassen sich durch intramolekulare nucleophile Substitution (SN2) in Gegenwart einer Base zu Epoxiden umsetzen.[4]
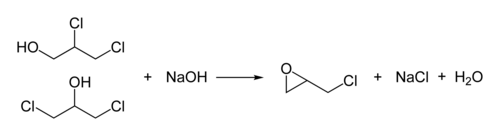
Technische Bedeutung hat die Herstellung von Epichlorhydrin. Durch Chlorhydrinierung von Allylchlorid mit hypochloriger Säure werden 1,3-Dichlor-propan-2-ol und 2,3-Dichlorpropan-1-ol[10] gewonnen:
Durch Umsetzen mit Natriumhydroxid entsteht racemisches Epichlorhydrin:
In gleicher Weise sind durch Chlorhydrinierung von Propen Propylenchlorhydrin (PCH) und Propylenoxid zugänglich.[11]
Epoxidierungen in biologischen Systemen können durch Halohydrindehalogenasen katalysiert werden.
Mit Hydroxid als Nucleophil lassen sich Halohydrine in Glycole umsetzen. Von technischer Bedeutung ist diese Reaktion bei der Synthese von Glycerol aus Propen über 3-Chlor-1,2-propandiol, welche die Halohydrin-Hydrolyse im letzten Schritt nutzt.[12]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Organikum, 16. Auflage, VEB Deutscher Verlag der Wissenschaften Berlin 1985, ISBN 3-326-00076-6, S. 254.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eckard Amelingmeier, Michael Berger, Uwe Bergsträßer, Henning Bockhorn, Peter Botschwina: RÖMPP Lexikon Chemie, 10. Auflage, 1996-1999. Thieme, 2014, S. 1674 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ United States. Customs Court: United States Customs Court Reports. The Court, 1973, S. 241 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ IUPAC: Halohydrins, from Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ↑ a b Radha R. Gupta, Mahendra Kumar, Vandana Gupta: Heterocyclic Chemistry. Springer Berlin Heidelberg, 2012, ISBN 978-3-642-72276-9, S. 309 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Monohydric Alcohols Their Ethers and Esters Sulphur Analogues Nitrogen Deri... Elsevier Science, ISBN 978-1-4832-2134-2, S. 297 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Organic Reaction Mechanisms 2009. Wiley, ISBN 978-1-119-96104-8 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ E. Buss, A. Rockstuhl, F. R. D. Schnurpfeil: Untersuchungen zum Mechanismus der Chlorhydrinierung von Olefinen. In: Journal für Praktische Chemie. 324, 1982, S. 197–208, doi:10.1002/prac.19823240204.
- ↑ Chemical Processing Handbook. CRC Press, ISBN 978-1-4822-7722-7, S. 390 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hanne Thomassen, Svein Samdal, Kenneth Hedberg: Conformational analysis. 20. 2-Bromoethanol and 2-iodoethanol. Structures, compositions, and anti-gauche energy and entropy differences from electron diffraction and structures and vibrational wavenumbers from an ab initio calculation. In: The Journal of Physical Chemistry. Band 97, Nr. 16, 1993, S. 4004–4010, doi:10.1021/j100118a014.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,3-Dichlorpropan-1-ol: CAS-Nr.: 616-23-9, EG-Nr.: 210-470-0, ECHA-InfoCard: 100.009.519, GESTIS: 17940, PubChem: 12018, ChemSpider: 11523, Wikidata: Q27269940.
- ↑ Patent DE 19614683, Verfahren zur Herstellung von Propylenoxid durch Chlorhydrinierung und Alkalilaugeverseifung, angemeldet 13. April 1996.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. Thieme, 2005, ISBN 978-3-13-541505-5, S. 219 (eingeschränkte Vorschau in der Google-Buchsuche).