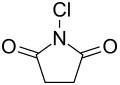
N-Chlorsuccinimid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N-Chlorsuccinimid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H4ClNO2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit Geruch nach Chlor[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 133,53 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,65 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
216,5 °C[1] | ||||||||||||||||||
| Löslichkeit |
14 g·l−1 in Wasser (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−357,9 kJ/mol[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
N-Chlorsuccinimid, meist kurz als NCS bezeichnet, ist das am Stickstoff chlorierte Imid der Bernsteinsäure.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]NCS kann durch Behandlung von Succinimid mit elementarem Chlor hergestellt werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die mittels DSC bestimmte Zersetzungswärme beträgt −215 kJ·mol−1 bzw. −1610 kJ·kg−1.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]NCS wird im Labormaßstab vor allem als Chlorierungsmittel eingesetzt, beispielsweise bei der Chlorierung von Alkenen in der Allylstellung oder von Alkylaromaten in der Benzylstellung. In größeren Mengen findet es bei der Produktion von pharmazeutischen Wirkstoffen (v. a. von Antibiotika) Verwendung. Verglichen mit elementarem Chlor (einem ätzenden, giftigen Gas) lässt sich NCS besser aufbewahren, handhaben und dosieren. Bei Umsatz von NCS entsteht als Nebenprodukt das wasserlösliche Succinimid.
Die Verwendung von N-Chlorsuccinimid als Chlorierungsmittel ist ein Beispiel für eine Synthesemethode, die mit geringer Atomökonomie abläuft.
Literatur
[Bearbeiten | Quelltext bearbeiten]- W. Gołebiewski, Mirosław Gucma: Applications of N -Chlorosuccinimide in Organic Synthesis. In: Synthesis. Band 2007, Nr. 23, Dezember 2007, S. 3599–3619, doi:10.1055/s-2007-990871.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt N-Chlorsuccinimid bei Merck, abgerufen am 28. Februar 2010.
- ↑ a b Datenblatt N-Chlorosuccinimide bei Sigma-Aldrich, abgerufen am 12. April 2011 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ Grewer, T.; Klais, O.: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften, VDI-Verlag, Schriftenreihe "Humanisierung des Arbeitslebens", Band 84, Düsseldorf 1988, ISBN 3-18-400855-X, S. 10.

