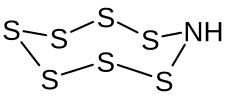
Heptaschwefelimid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Heptaschwefelimid | |||||||||
| Summenformel | NHS7 | |||||||||
| Kurzbeschreibung |
blassgelber Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 239,77 g·mol−1 | |||||||||
| Dichte |
2,01 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Heptaschwefelimid ist eine anorganische chemische Verbindung des Schwefels. Sie gehört zur Stoffgruppe der Schwefelimide. Die Struktur der Schwefel-Stickstoff-Verbindung entspricht formal der des Cyclooctaschwefels S8.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Das Heptaschwefelimid kann durch die Umsetzung von Schwefel mit Natriumazid in Hexamethylphosphorsäuretriamid hergestellt werden. Dabei resultiert zunächst ein Natriumsalz, dessen Protolyse zum freien Imid führt.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Heptaschwefelimid ist ein blassgelber Feststoff, der bei 113,5 °C schmilzt. Die Verbindung kristallisiert in einem rhombischen Kristallsystem.[4]
Es besitzt die Eigenschaften einer schwachen Säure, da entsprechende Salze wie S7NNa oder S7N-Hg-NS7 bekannt sind.[1] Die Umsetzung von Heptaschwefelimid mit den entsprechenden Schwefeldichloriden SnCl2 mit n = 1, 2, 3, 5 ergeben die Oligoschwefeldinitride SxN2 mit x = 15, 16, 17, 19.[1][5] Es ergibt sich eine Grundstruktur S7N–Sn–NS7, wobei zwei S7N-Ringstrukturen über ein, zwei, drei bzw. fünf Schwefelatome verbunden sind.[6]
Ähnliche Substitutionsreaktionen sind auch mit anderen Halogenverbindungen möglich. Mit Thionylchlorid wird das Bis(heptaschwefelimido)-sulfoxid erhalten.[1]
Analog erfolgt mit Verbindungen wie Bortrichlorid, Bortribromid oder Acetylchlorid eine Substitution an der NH-Struktur.[1]
Die Umsetzung mit Trimethylsilyldimethylamin ergibt die entsprechende Substitution mit der Trimethylsilylgruppe.[1]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Wiberg, E.; Wiberg, N.; Holleman, A.F.: Anorganische Chemie, 103. Auflage, 2017 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-026932-1, S. 679–680, (abgerufen über De Gruyter Online).
- ↑ Goehring, M.; Herb, H.; Koch, W.: Über das Heptaschwefelimid, S7NH in Z. Anorg. Chem. 264 (1951) 137–143, doi:10.1002/zaac.19512640207.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Wang, Chih-Chieh; Hong, Ying-Ying; Ueng, Chun-Her; Wang, Yu: Charge-density distribution of heptasulfur imide (S7NH) in J. Chem. Soc., Dalton Trans.: Inorg. Chem. (1972–1999), 23 (1992) 3331–3336, doi:10.1039/DT9920003331.
- ↑ Becke-Goehring, M.; Jenne, H.; Rekalic, V.: Über die Schwefelnitride S15N2 und S16N2 in Chem. Ber. 92 (1959) 855–857, doi:10.1002/cber.19590920413.
- ↑ Eintrag zu Schwefel-Stickstoff-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. März 2017.
![{\displaystyle {\ce {7/8 S8 + NaN3 -> N2 + S7N^{-}Na^+ ->[H^+] S7NH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a5731b866efdbe56552e549106788b5a71107884)





