Heterobenzole

Heterobenzole sind Heteroaromaten mit der Summenformel
- C5H5E (E = N, P, As, Sb, Bi)[1] oder
- C5H6E (E = Si, Ge, Sn)
Erstere leiten sich vom Benzol (C6H6) ab, indem eine Methingruppe (CH) durch ein (isoelektronisches) Heteroatom der 15. Gruppe des Periodensystems (PSE) ersetzt wurde. Letztere enthalten – wie Benzol – sechs Wasserstoffatome jedoch ein Kohlenstoffatom weniger, dieses ist durch ein anderes Element aus der 14. Gruppe des PSE ersetzt worden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Allen Heterobenzolen ist ihre Aromatizität gemeinsam. Die Stabilität nimmt mit steigender Ordnungszahl des Heteroatoms ab. Nachfolgend sind die Bindungslängen und -winkel der Heterobenzole der 15. Gruppe des Periodensystems dargestellt (von links nach rechts: Pyridin, Phosphabenzol, Arsabenzol, Stibabenzol und Bismabenzol):[2]

Bindungslängen und -winkel verschiedener Heterobenzole (von links nach rechts: Pyridin, Phosphabenzol, Arsabenzol, Stibabenzol und Bismabenzol)
Eine Zusammenstellung von Eigenschaften, Synthesen und Reaktionen der Pyridin-Homologen Phosphabenzol und Arsabenzol lieferte Gottfried Märkl 1982.[3]
Silabenzol, Germabenzol und Stannabenzol sind aromatische Heterobenzole, die im Sechsring je ein Heteroatom (Si, Ge oder Sn) aus der 14. Gruppe des PSE enthalten.
Vorkommen und Synthese
[Bearbeiten | Quelltext bearbeiten]Vorkommen
[Bearbeiten | Quelltext bearbeiten]

Von geschichtlicher Bedeutung ist die Gewinnung von Pyridin aus Steinkohlenteer, in dem es zu etwa 0,1 % enthalten ist.[4] Es sind nur wenige natürliche Vorkommen freien Pyridins bekannt. Es konnte jedoch in den flüchtigen Bestandteilen des Eibischs[5] sowie den Blättern und Wurzeln der Schwarzen Tollkirsche (Atropa belladonna)[6] nachgewiesen werden. Über natürliche Vorkommen von Phosphabenzol, Arsabenzol, Stibabenzol und Bismabenzol sowie Silabenzol, Germabenzol und Stannabenzol ist nichts bekannt.
Synthese
[Bearbeiten | Quelltext bearbeiten]Moderne industrielle Synthesen von Pyridin nutzen die von Tschitschibabin 1924 erstmals publizierte Route,[7] wobei es sich um eine Multikomponentenreaktion zwischen Ketonen oder Aldehyden mit Ammoniak handelt.
Phosphabenzol, Arsabenzol, Stibabenzol und Bismabenzol werden nicht im technischen Maßstab hergestellt. Sie besitzen jedoch ein beträchtliches akademisches Interesse.
Die Übertragung der Diltheyschen Pyridinsynthese aus Pyriliumsalzen und Ammoniak gelang – unter variierenden Reaktionsbedingungen – auch auf die Darstellung von 2,4,6-trisubstituierten Phosphabenzolen aus Phosphorwasserstoff (PH3).[3]
Die erste Synthese eines substituierten Arsabenzols – genauer 9-Arsaanthracen – wurde von Peter Jutzi und Friedrich Bickelhaupt beschrieben.[8]
Eine Synthese für die Grundkörper mehrerer Heterobenzole wurde – ausgehend von Trihalogeniden (X = Cl, Br) der Elemente der 15. Gruppe des Periodensystems (E = P, As, Sb, Bi) – von Arthur J. Ashe III beschrieben:[1]

Phosphabenzol (E = P) und Arsabenzol (E = As) konnten so als destillierbare Flüssigkeiten erhalten werden. Auch Stibabenzol (E = Sb) wurde erhalten, es ist jedoch eine labile Substanz, die bei Raumtemperatur schnell polymerisiert. Hingegen konnte Bismabenzol (E = Bi) nicht in Substanz isoliert, jedoch spektroskopisch und durch gezielte Derivatisierung nachgewiesen werden.[8]
2-Silanaphthalin 1 wurde von einer japanischen Gruppe 1997 als erstes Silabenzol-Derivat hergestellt.[9][10] Die Autoren Norihiro Tokitoh und Renji Okazaki berichteten danach auch über die Synthese eines thermisch stabilen Silabenzols 2, das durch einen sterisch anspruchsvollen Substituenten stabilisiert ist.[11]
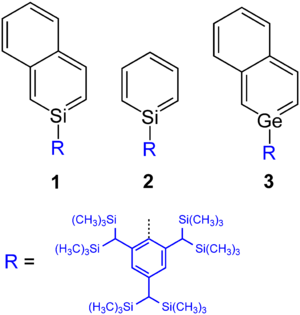
Der Grundkörper Germabenzol wurde theoretisch betrachtet,[12] jedoch bisher nicht synthetisiert. Hingegen ist eine 2-Germanaphthalin-abgeleitete stabile Substanz 3 hergestellt worden.[13]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b C. Elschenbroich: Organometallics. Wiley-VCH, Weinheim 2006, ISBN 3-527-29390-6, S. 229–230.
- ↑ Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner Verlag, Wiesbaden 2008, S. 218 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 25. Februar 2010]).
- ↑ a b Gottfried Märkl: Phosphabenzol und Arsabenzol. Die höheren Elementhomologen des Pyridins. Chemie in unserer Zeit 16 (1982), S. 139–148, doi:10.1002/ciuz.19820160503.
- ↑ A. Gossauer: Struktur und Reaktivität der Biomoleküle. Wiley-VCH, Weinheim 2006, ISBN 3-906390-29-2, S. 488.
- ↑ A. Täufel, W. Ternes, L. Tunger, M. Zobel: Lebensmittel-Lexikon. 4. Auflage, S. 450, Behr Verlag, 2005, ISBN 3-89947-165-2.
- ↑ G. A. Burdock (Hrsg.): Fenaroli’s Handbook of Flavor Ingredients. Band II, 3. Auflage, CRC Press, Boca Raton, 1995, ISBN 0-8493-2710-5.
- ↑ A. Tschitschibabin in: J. Prakt. Chem., 1924, 107, S. 122.
- ↑ a b A. J. Ashe: The Group 5 Heterobenzenes. In: Accounts of Chemical Research. Band 11, Nr. 4, 1978, S. 153–157, doi:10.1021/ar50124a005.
- ↑ Norihiro Tokitoh, Keiji Wakita, Renji Okazaki, Shigeru Nagase, Paul von Ragué Schleyer, Haijun Jiao: A Stable Neutral Silaaromatic Compound, 2-{2,4,6-Tris[bis(trimethylsilyl)methyl]phenyl}-2-silanaphthalene. In: Journal of the American Chemical Society. 119, 1997, S. 6951–6952, doi:10.1021/ja9710924.
- ↑ Keiji Wakita, Norihiro Tokitoh, Renji Okazaki, Shigeru Nagase, Paul von Ragué Schleyer, Haijun Jiao: Synthesis of Stable 2-Silanaphthalenes and Their Aromaticity. In: Journal of the American Chemical Society. 121, 1999, S. 11336–11344, doi:10.1021/ja992024f.
- ↑ Keiji Wakita, Norihiro Tokitoh, Renji Okazaki, Nozomi Takagi, Shigeru Nagase: Crystal Structure of a Stable Silabenzene and Its Photochemical Valence Isomerization into the Corresponding Silabenzvalene. In: Journal of the American Chemical Society. 122, 2000, S. 5648–5649, doi:10.1021/ja000309i.
- ↑ Ebrahimi, A. A.; Ghiasi, R.; Foroutan-Nejad, C.: Topological Characteristics of the Ring Critical Points and the Aromaticity of Groups IIIa to VIa Hetero-Benzenes. In: Journal of Molecular Structure: THEOCHEM. Band 941, Nr. 1–3, 2010, S. 47–52, doi:10.1016/j.theochem.2009.10.038.
- ↑ N. Nakata, N. Takeda, N. Tokitoh: Synthesis and Structure of a Kinetically Stabilized 2-Germanaphthalene: The First Stable Neutral Germaaromatic Compound. In: Organometallics. Band 20, Nr. 26, 2001, S. 5507–5509, doi:10.1021/om010881y.
