Hormon



Ein Hormon ist ein biochemischer Botenstoff, der von speziellen Zellen (in endokrinen Drüsen oder Zellgeweben) produziert und als körpereigener Wirkstoff in den Körperkreislauf abgegeben wird. Dieser Signalstoff setzt dann an bestimmten Zellen der Erfolgsorgane spezifische Wirkungen oder Regulationsfunktionen in Gang, vor allem bei bestimmten Stoffwechselvorgängen. Der dadurch ausgelöste biologische Prozess stellt einen Spezialfall der Signaltransduktion dar. Chemisch sind Hormone niedermolekulare Verbindungen oder gelegentlich auch Peptide (sogenannte Peptidhormone).
Die Wissenschaft zur Erforschung der Hormone bezeichnet man als Endokrinologie. Entsprechend ist ein Endokrinologe ein Wissenschaftler oder Arzt, der sich mit der Erforschung der Hormone, ihrer Wirkungsweisen und mit Erkrankungen des hormonalen Geschehens beschäftigt. Das 1905/1906 erstmals von Ernest Starling[1] für die Wirkstoffe innersekretorischer Drüsen benutzte Wort Hormon leitet sich ab von altgriechisch ὁρμᾶν hormān ‚antreiben, erregen‘.[2]
Begriffsbestimmung
[Bearbeiten | Quelltext bearbeiten]Das Wort Hormon, englisch hormone, ist abgeleitet von altgriechisch ὁρμᾶν hormā́n „in Bewegung setzen, antreiben, anregen“.[3] Die Bezeichnung wurde Anfang des 20. Jahrhunderts erstmals verwendet. Dem 1905 gemachten Vorschlag eines ihrer Mitarbeiter folgend,[4] prägten Ernest Starling und William Maddock Bayliss[5] 1906 den Begriff. Aus dieser Zeit stammt der klassische Hormonbegriff, nach dem Hormone körpereigene Stoffe sind, die aus einer Drüse (glandulär) in den Blutkreislauf (endokrin) abgegeben werden, um als „chemischer Bote“ in anderen Organen eine spezifische Wirkung zu erzielen (Beispiele: Schilddrüse, Nebennieren, Bauchspeicheldrüse). In Analogie dazu werden bei Gliederfüßern und Weichtieren Botenstoffe als Hormone angesehen, die über die Hämolymphe an ihren Wirkort gelangen. Diese klassische Definition findet bis heute Anwendung, wurde aber vielfach modifiziert und erweitert.
So wurde der Hormonbegriff um aglanduläre Hormone erweitert, die wie klassische Hormone endokrin, aber nicht aus Drüsen freigesetzt werden. Beispiele hierfür sind Calcitriol, Erythropoietin und das atriale natriuretische Peptid sowie verschiedene Substanzen, die von Nervenzellen als Neurosekretorische Zellen produziert und ins Blut abgegeben wirken (Neurohormone).[6] Auch körpereigene Stoffe aus spezialisierten Zellen, die nach Abgabe unter Umgehung des Blutwegs direkt im unmittelbar benachbarten Gewebe (parakrin) ihre Wirkung erzielen, werden gelegentlich als Hormone bezeichnet (Gewebshormone).
Anhand ihrer Wirkungsschwerpunkte werden von den Hormonen die Zytokine abgegrenzt, die Wachstum, Proliferation und Differenzierung von Zellen regulieren. Zytokine werden aglandulär von Zellen sezerniert, deren Aufgabe nicht allein in der Sekretion solcher Stoffe besteht; sie wirken typischerweise autokrin oder parakrin. Auch Neurotransmitter, die von Nervenzellen in den synaptischen Spalt abgegeben werden, um an benachbarten Zielzellen, meist Nervenzellen, ihre Wirkung zu entfalten, werden in der Regel nicht als Hormone bezeichnet.[7]
Hormone wirken nur auf bestimmte Zielorgane, in deren Gewebe sich Zellen finden, die jeweils spezifische Hormonrezeptoren tragen, an welche die Hormonmoleküle binden. Häufig sind diese Rezeptoren Membranproteine, die auf der Zelloberfläche das Hormon binden und auf der Innenseite der Membran nach Hormonbindung Signale auslösen. Einige Hormone (Schilddrüsenhormon, Vitamin D3 und die Steroidhormone, s. u.) erreichen ihre Rezeptoren erst, wenn sie die Zellmembran per Diffusion durchdrungen haben, denn ihre Rezeptoren liegen im Zytoplasma und im Karyoplasma vor. Nach der Bindung von Signalstoff und Rezeptor aggregieren die Rezeptor/Hormon-Komplexe zu Dimeren und erreichen so den Zellkern, wo sie die Aktivierung von Genen beeinflussen.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Hormone wurden in den frühen Jahrzehnten des 20. Jahrhunderts entdeckt; der Begriff Hormon wurde 1905 von Ernest Starling geprägt. Er entdeckte, dass bei der Stimulation durch Salzsäure aus der Darmwand ein Stoff freigesetzt wurde, der die Pankreas-Sekretion anregte (ein Augenzeugenbericht[8]). Diesen Stoff nannte er Sekretin.
Bereits in der Gentilgesellschaft wurden verschiedene Organe von Tieren zur Heilung von Krankheiten verzehrt. Im Papyrus Ebers, im Corpus Hippocraticum und in weiteren Werken römischer und mittelalterlicher Ärzte gab es Abschnitte, die die Verwendung von Tierorganen zur Behandlung von Krankheiten darstellten (z. B. Tierhoden zur Steigerung der Potenz). Théophile de Bordeu stellte im 18. Jahrhundert seine Theorie von in bestimmten Organen (etwa den Keimdrüsen) gebildeten Substanzen auf, die über den Blutstrom Wirkung an entfernten Körperregionen ausüben.[9] In den Apotheken gab es bis ins 18. Jahrhundert vielfältige aus Organen, Organsäften und Ausscheidungen von Tieren hergestellte Arzneimittel, die bereits im Sinne einer Organtherapie (oder Organotherapie) verwendet wurden.[10] Die Entdeckung des Blutkreislaufes erzeugte anschließend die Vorstellung, dass diese Organe spezifische Stoffe produzieren, die im Blut durch den Körper zirkulieren. Dabei unterschied 1830 Johannes Müller zwischen Drüsen mit innerer und äußerer Sekretion. Dies konnte Arnold Adolf Berthold bestätigen, indem er durch eine Hodentransplantation bei Kapaunen eine endokrine Drüse entdeckte. Charles-Édouard Brown-Séquard wies die Notwendigkeit dieser Drüsen für das Überleben durch eine Nebennieren-Ektomie an Versuchstieren nach. Er empfahl 1889 auch die Injektion von Hodenextrakten beim Menschen zur Verbesserung des körperlichen und geistigen Wohlbefindens. Diese Extrakte zeigten keinerlei Wirkung. Brown-Séquard gilt als der Begründer der Organtherapie. Später wurden weitere Extrakte aus Nebennieren, Schilddrüsen, Eierstöcken und Stierhoden in die Therapie eingeführt. 1901 wurde das erste Hormon (Adrenalin) entdeckt; es wurde 1904 erstmals synthetisiert.[5]
Hormonbildende Zellen
[Bearbeiten | Quelltext bearbeiten]Hormone werden von speziellen hormonproduzierenden Zellen gebildet: Diese befinden sich in Drüsen in der Hirnanhangdrüse (Hypophyse), der Zirbeldrüse, der Schilddrüse, der Nebenniere und in den Langerhans’schen Inselzellen der Bauchspeicheldrüse. Einige Hormone werden auch von Nervenzellen gebildet, diese nennt man Neurohormone oder Neuropeptide. Hormone des Magen/Darm-Traktes finden sich verteilt in den Lieberkühn-Krypten. Zudem werden in der Leber Vorstufen des Angiotensins gebildet. Geschlechtshormone werden von spezialisierten Zellen der weiblichen oder männlichen Geschlechtsorgane gebildet: Theca- und Granulosazellen bei der Frau und Leydig-Zellen beim Mann.
Charakteristisch für die hormonproduzierenden Zellen sind Enzyme, die nur in diesen Zellen vorkommen. Die Freisetzung der Hormone ist individuell für jedes Hormon geregelt. Häufig werden Hormone in der Zelle gespeichert und nach Stimulation durch einen Freisetzungsstimulus freigesetzt. Die Freisetzungsstimuli können z. B. Releasing-Hormone sein (Freisetzungshormone, auch Liberine genannt, siehe unten).
Hormon-Kaskaden
[Bearbeiten | Quelltext bearbeiten]Häufig finden sich hormonelle Achsen:
- die hypothalamisch-hypophysär-gonadotrope Achse: Das Gonadotropin-Releasing Hormon (GnRH) aus Nervenzellen des Hypothalamus setzt in der Hypophyse die Gonadotropine frei, die wiederum in den Geschlechtsorganen die Bildung von Sexualsteroiden anregen.
- die hypothalamisch-hypophysär-adrenotrophe Achse: Das Corticotropin-Releasing Hormon (CRH) aus Nervenzellen des Hypothalamus setzt in der Hypophyse das ACTH frei, das in der Nebenniere die Cortisol-Bildung anregt.
- die hypothalamisch-hypophysär-thyreotrophe Achse: Thyreotropin-Releasing Hormon (TRH) aus Nervenzellen des Hypothalamus setzt in der Hypophyse das Thyrotropin frei, das in der Schilddrüse die Freisetzung des Thyroxin und des Trijodthyronin anregt.
Hormonfreisetzung
[Bearbeiten | Quelltext bearbeiten]Die Hormonfreisetzung (mit Ausnahme der parakrinen Stimulatoren) erfolgt in der Nähe von Blutgefäßen, die viele kleine Fenster haben, durch die Hormone direkt ins Blut übergehen können. Bei auf die Sekretion von Neuropeptiden spezialisierten Stellen spricht man von Neurohämalorganen. Durch die Bindung eines Stimulus für die Hormonfreisetzung kommt es häufig in der Zelle zu einem Anstieg der intrazellulären Calciumkonzentration. Dieser Calcium-Anstieg erlaubt die Fusion der Zellorganellen, in denen sich die vorgefertigten Hormone befinden, mit der Zellmembran. Sobald die Organellenmembran mit der Zellmembran fusioniert ist, haben die Hormone freien Zugang zum Raum außerhalb der Zelle und können in die dort benachbarten Blutgefäße durch die gefensterte Blutgefäßwand wandern.
Hormonähnliche Stoffe
[Bearbeiten | Quelltext bearbeiten]Die bei Pflanzen vorkommenden Hormone werden als Phytohormone bezeichnet. Sie teilen mit den tierischen Hormonen die Eigenschaft, Signalwirkung über eine größere Distanz zu entfalten und in geringen Konzentrationen wirksam zu sein.
Die bei Tieren vorkommenden Pheromone sind Botenstoffe zwischen Individuen. Sie sind nicht an den Organismus gebunden, in dem sie gebildet wurden und können über große Distanzen signalisieren.
Beispiele für hormonelle Regulation
[Bearbeiten | Quelltext bearbeiten]
- Stoffwechsel (Zuckerstoffwechsel, Fettstoffwechsel), Nahrungsaufnahme
- Aufrechterhaltung der Homöostase
- Sexualentwicklung und Sexualtrieb
- Menstruationszyklus der Frau
- Knochenwachstum
- Muskelaufbau
- Geistige Aktivität, Anpassung an Angst und Stress
- Thyreotroper Regelkreis
Hormone werden selber:
- durch Regelkreise (Rückkopplung, feedback system; in der hypothalamisch-hypophysären-thyreotrophen Achse zum Beispiel unterdrückt das Endprodukt Schilddrüsenhormon (Trijodthyronin) die Bildung des TRH im Hypothalamus und des Thyreotropins aus der Hypophyse.),
- Die Freisetzung der meisten Hormone wird durch negative Rückkopplungen gesteuert, wie beispielsweise die der Glukokortikoide der Nebennierenrinde. Der Hypothalamus setzt das Corticotropin-releasing-Hormon (CRH) frei, das in der Hypophyse die Freisetzung des Adrenocorticotropen Hormons (ACTH) stimuliert (blauer Pfeil +). Dieses stimuliert in der Nebennierenrinde die Bildung und Freisetzung von Kortisol und anderen Glukokortikoiden (blauer Pfeil +). Über das Blut in das Gehirn und die Hypophyse gebracht unterdrückt Kortisol andererseits die Bildung und Freisetzung von CRH und ACTH (rote Pfeile −), wodurch die Kortisolbildung wieder aussetzt.[11]
- durch das autonome Nervensystem sowie
- durch nichthormonelle chemische Botenstoffe wie zum Beispiel die Kalziumkonzentration oder die Glukosekonzentration im Blut reguliert.
Einteilung
[Bearbeiten | Quelltext bearbeiten]Nach chemischer Klassifikation
[Bearbeiten | Quelltext bearbeiten]- Protein- und Peptidhormone mit charakteristischer Aminosäuresequenz
- Neuropeptide des Hypothalamus:
- Freisetzungshormone für LH/FSH, TSH, ACTH, GH
- Somatostatin
- Agouti-ähnliches Peptid (AgRP)
- Neuropeptid Y (NPY)
- Leptin
- Ghrelin
- Glykoproteinhormone der Adenohypophyse:
- Follikelstimulierendes Hormon (Follitropin, FSH)
- Luteinisierendes Hormon (Luteotropin, LH)
- Thyreoidea-stimulierendes Hormon (Thyreotropin, TSH)
- Adrenocorticotropes Hormon (Adrenocorticotropin, ACTH)
- weitere adenohypophysäre Hormone:
- Neuropeptide der Neurohypophyse:
- Antidiuretisches Hormon (Adiuretin, Vasopressin, ADH)
- Oxytocin
- Hormone der Schilddrüsen
- Hormone der Nebenschilddrüsen
- Parathormon (PTH)
- Hormon des Herzen
- Hormone der pankreatischen Inselzellen:
- Peptidhormone des Magen- und Darmtraktes
- Cholecystokinin (CCK)
- Sekretin
- Gastrin
- Ghrelin
- Vasoaktives intestinales Peptid (VIP)
- Glukoseabhängiges insulinotropes Peptid (GIP)
- Peptid YY (PYY)
- Peptidhormon der Leber
- Insulinähnliche Wachstumsfaktoren (Somatomedine, IGF)
- Proteinhormone der Gonaden
- Neuropeptide des Hypothalamus:
- Protein/Peptid-Hormone bei Vertebraten, nicht beim Menschen gefunden
- bei Lurchen
- bei Fischen
- Stanniokalzin; jetzt auch beim Menschen (und weiteren Vertebraten) zwei Stanniokalzine mit noch unbekannter Funktion gefunden
| Katecholamine |
|---|
 Adrenalin |
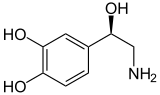 Noradrenalin |
- Aminosäurederivate
- Katecholamine
- Thyroxin (T4) und Triiodthyronin (T3)
- Serotonin
- Melatonin
- Histamin
- Isoprenderivate – wie Juvenilhormon und Neotenin bei Insekten
- Steroidhormone – wie die Nebennierenrinden- und Geschlechtshormone
- Mineralocorticoide – wie Aldosteron
- Glucocorticoide – wie Cortisol
- Estrogene – wie Estradiol
- Gestagene – wie Progesteron
- Androgene – wie Testosteron
- Dehydroepiandrosteron (DHEA)
- Arachidonsäurederivate (Eicosanoide)
Nach Herkunft
[Bearbeiten | Quelltext bearbeiten]Es gibt spezielle Hormondrüsen, in denen hormonbildende Zellen im engen Verbund zusammenhängen. Viele Hormone werden aber von Zellen gebildet, die nicht ausschließlich mit hormonbildenden Zellen im Verbund stehen. So liegen die G-Zellen, die Gastrin bilden, vereinzelt im pylorischen Antrum des Magens vor. Ähnlich ist es mit den Zellen für die Hormone Cholezystokinin, Sekretin oder Somatostatin in der Darmwand.
Entscheidend für die Hormonproduktion ist nicht die äußere Umgebung einer Zelle, sondern die Ausrüstung innerhalb mit den charakteristischen Enzymen.
- Spezialisierte Hormondrüsen
- Hypophyse
- Hypophysen-Vorderlappen, die Adenohypophyse: Hier werden LH/FSH, ACTH, Prolaktin, GH und TSH gebildet.
- Hypophysen-Hinterlappen, Neurohypophyse: Diese ist keine Hormondrüse im eigentlichen Sinne, da hier die Hormone Oxytozin und Vasopressin (Adiuretin) an Nervenenden ausgeschüttet werden, wobei die Nervenzellkerne sich im Hypothalamus befinden und deren Nervenbahnen durch den Hypophysenstiel laufen.
- Zirbeldrüse: Bildung des Hormons Melatonin
- Schilddrüse: Bildung des Schilddrüsenhormons (T3, T4, Calzitonin)
- Nebenschilddrüse (Parathyroidea): Bildung von Parathormon (Gegenspieler von Calzitonin)
- Nebenniere: Bildung von Aldosteron (Mineralokortikoid), Androgenen (Androstendion) und Adrenalin (Epinephrin).
- Inselzellen in der Bauchspeicheldrüse: Bildung von Insulin, Glukagon, Somatostatin und Pankreatischem Polypeptid
- Hypophyse
- Neurohormone, die von Neuronen im ZNS produziert werden.
- Hypothalamische Neuropeptide: Bildung von GnRH, CRH, TRH oder GHRH: Speicherung an den Nervenenden in der Eminentia mediana; Bildung von Oxytozin und Vasopressin (Adiuretin), Speicherung an den Nervenenden in der Neurohypophyse; Bildung von NPY, GHrelin, Agouti-ähnlichem Peptid
- Gewebe mit Hormonbildenden Zellen:
- Haut: Bildung von Vitamin D3 durch Bestrahlung von 7-Dehydrocholesterin mit UV-Licht
- Herz: Bildung des Atrial-Natriuretischen Peptides durch Muskelzellen (Myozyten) des rechten Herzvorhofes
- Leber: Bildung des Angiotensinogen, des Vorläufers des Angiotensin, Bildung von Insulin-ähnlichen Wachstumsfaktoren (IGF)
- Magen- und Darmtrakt (Enterohormone): Bildung von Cholezystokinin, Gastrin, Sekretin, Ghrelin aus einzeln in die Magen- oder Darmwand verteilten endokrinen Zellen.
- Gonaden
- Hoden: Bildung von Testosteron (und Estradiol) durch die Leydig-Zellen, von Inhibin und Aktivin
- Ovarien: Bildung von Testosteron durch Theka-Zellen und von Estradiol durch Granulosa-Zellen, Bildung von Inhibin und Aktivin
- Weitere Organe mit Steuerungsfunktion bestimmter endokriner Regelkreise
- Niere: Die Zellen des juxtaglomerulären Apparates setzen bei erniedrigtem Blutdruck das Enzym Renin frei, das das Angiotensinogen aus der Leber zum Angiotensin I spaltet.
- Lunge: Hier wird das Angiotensin I durch das Angiotensin-konvertierende Enzym (ACE) zum wirksamen Angiotensin II verkürzt.
Biochemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Man unterscheidet zwischen zwei Arten von Hormonen:
- Wasserlösliche Hormone:
Diese Substanzen können wegen ihrer Lipidunlöslichkeit die Zellmembran nicht passieren. Stattdessen binden sie sich an spezifische membrangebundene Rezeptoren der Zielzellen. Zusammen mit dem Rezeptor wird ein Hormon-Rezeptor-Komplex gebildet. Dieser aktivierte Rezeptor fungiert im Zellinneren dann wie ein Enzym, das indirekt verschiedenste biochemische Mechanismen in Gang setzen kann (Signaltransduktion).
- Ein sehr verbreitetes Prinzip der Signaltransduktion ist G-Protein-gekoppelte 7-Transmembranhelixrezeptor. Hier wird dadurch, dass ein Ligand außen an der Zelle an den Rezeptor bindet (welcher die Zellmembran überspannt), im Rezeptor eine Konformationsänderung ausgelöst, wodurch dann in der Zelle ein heterotrimeres G-Protein an den Rezeptor binden kann. Dadurch wird das Protein (z. B. Gs) aktiviert und bildet wie ein Enzym den second messenger cAMP. Dieser wiederum kann dann via PKA glatte Muskulatur relaxieren oder beispielsweise auch die Expression bestimmter Gene via CREB fördern.
- Lipidlösliche Hormone:
Diese Substanzen können aufgrund ihrer Lipidlöslichkeit durch die Zellmembran in die Zelle eindringen. Der Stoff bindet im Cytoplasma an intrazelluläre Rezeptoren und bildet einen Hormon-Protein-Komplex. Dieser Komplex hat die Fähigkeit, durch die Kernmembran zur DNA zu gelangen, oder ist wie im Falle der Schilddrüsenhormone bereits an die DNA gebunden, um die Expression bestimmter Gene zu fördern.
- Eine wichtige Klasse innerhalb der fettlöslichen Hormone sind, neben den Schilddrüsen-Hormonen, die Steroidhormone. Steroidhormone stammen alle vom Cholesterin ab. Die beiden wichtigsten Orte der Steroidhormonproduktion sind die Nebennierenrinden und die Gonaden (Hoden und Eierstöcke) für die Sexualhormone. Das sehr kleine hormonell wirksame Stickstoffmonoxid (NO) wird wegen dessen hoher Membranpermeabilität ebenfalls zu den lipophilen Hormonen gezählt.

Pflanzenhormone
[Bearbeiten | Quelltext bearbeiten]Liste von pflanzlichen Hormonen:
- Auxin
- Cytokinin
- Ethylen
- Abszisinsäure
- Gibberellinsäure
- Brassinosteroid
- Jasmonsäure
- Salicylsäure
- Strigolacton
Hormone in der Umwelt
[Bearbeiten | Quelltext bearbeiten]Besondere Aufmerksamkeit verdient die Tatsache, dass Hormone zunehmend in die Umwelt eingetragen werden und später über die pflanzliche und tierische Nahrungskette in ungünstiger und unkontrollierter Dosierung vom Menschen wieder aufgenommen werden. Ein Beispiel sind die Hormone der Anti-Baby-Pille, die von Kläranlagen nicht abgebaut werden. Sie werden mit dem gereinigten Wasser in die Flüsse eingeleitet.
Da die Kläranlagen auf den Medikamenteneintrag nicht ausgelegt sind, gelangen Medikamente und ihre Rückstände fast ungehindert über die Oberflächengewässer auch wieder ins Trinkwasser. Mehr als 180 der 3000 in Deutschland zugelassenen Wirkstoffe lassen sich in deutschen Gewässern nachweisen: Von Hormonen und Lipidsenkern über Schmerzmittel und Antibiotika bis hin zum Röntgenkontrastmittel.[12]
Auch bestimmte Schadstoffe wie beispielsweise DDT, PCB, PBDE oder Phthalate wirken wie Hormone und beeinflussen etwa die immer früher einsetzende erste Monatsperiode bei Mädchen.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Elisabeth Buchner: Wenn Körper und Gefühle Achterbahn spielen. ISBN 3-934246-00-1.
- Hermann Giersberg: Hormone. (= Verständliche Wissenschaft. Band 32). Springer, Berlin u. a.
- Bernhard Kleine: Hormone und Hormonsystem. Springer, 2007, ISBN 3-540-37702-6; 4. Auflage ebenda 2021, ISBN 978-3662585016.
- P. Reed Larsen: Williams Textbook of Endocrinology. 10. Auflage. Saunders, Philadelphia/PA 2003
- Lois Jovanovic, Genell J. Subak-Sharpe: Hormone. Das medizinische Handbuch für Frauen. (Originalausgabe: Hormones. The Woman’s Answerbook. Atheneum, New York 1987) Aus dem Amerikanischen von Margaret Auer, Kabel, Hamburg 1989, ISBN 3-8225-0100-X.
- Ulrich Meyer: Die Geschichte der Östrogene. In: Pharmazie in unserer Zeit, Band 33, Nr. 5, 2004, S. 352–356.
- Katharina Munk: Grundstudium Biologie – Zoologie. Spektrum Akademischer Verlag 2002, ISBN 3-8274-0908-X.
- Heinz Penzlin: Lehrbuch der Tierphysiologie. 7. Auflage. Spektrum Akademischer Verlag 2009, ISBN 3-8274-2114-4.
- Otto Westphal, Theodor Wieland, Heinrich Huebschmann: Lebensregler. Von Hormonen, Vitaminen, Fermenten und anderen Wirkstoffen. Societäts-Verlag, Frankfurt am Main 1941 (= Frankfurter Bücher. Forschung und Leben. Band 1), insbesondere S. 9–35 (Geschichte der Hormonforschung).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Hans Trachsel: Hormone ( vom 2. März 2008 im Internet Archive) Uni Bern
- Geschichte der Biologie: Hormonforschung ( vom 3. November 2014 im Internet Archive)
- Hormone im Wasser: Was bewirken sie bei Mensch und Tier? – Eidgenössisches Departement für Umwelt, Verkehr, Energie und Kommunikation (UVEK), Schweiz
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 55.
- ↑ Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. G. Freytag Verlag/Hölder-Pichler-Tempsky, München/Wien 1965.
- ↑ DWDS.
- ↑ Otto Westphal, Theodor Wieland, Heinrich Huebschmann: Lebensregler. Von Hormonen, Vitaminen, Fermenten und anderen Wirkstoffen. Societäts-Verlag, Frankfurt am Main 1941 (= Frankfurter Bücher. Forschung und Leben. Band 1), insbesondere S. 9–35 (Geschichte der Hormonforschung), hier: S. 20.
- ↑ a b Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarb. und erw. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2005, ISBN 978-3-8047-2113-5, S. 87 f.
- ↑ Kacsoh, Balint: Endocrine physiology. McGraw-Hill, Health Professions Division, New York 2000, ISBN 0-07-034432-9 (englisch).
- ↑ Peter Karlson, Detlef Doenecke, Jan Koolman, Georg Fuchs, Wolfgang Gerok: Karlsons Biochemie und Pathobiochemie. Georg Thieme Verlag, 2005, ISBN 3-13-357815-4, Hormone und hormonähnliche Signalstoffe, S. 517–582.
- ↑ C. J. Martin: Ernest Henry Starling, C.M.G., M.D., F.R.S. In: British medical journal, Band 1, Nummer 3462, Mai 1927, S. 900–906, PMID 20773196. PMC 2454704 (freier Volltext).
- ↑ Théophile de Bordeu: Analyse medicinale du sang. Montpellier 1775.
- ↑ Otto Westphal, Theodor Wieland, Heinrich Huebschmann: Lebensregler. Von Hormonen, Vitaminen, Fermenten und anderen Wirkstoffen. Societäts-Verlag, Frankfurt am Main 1941 (= Frankfurter Bücher. Forschung und Leben. Band 1), insbesondere S. 9–35 (Geschichte der Hormonforschung), hier: S. 9 f.
- ↑ P. H. Raven, G. B. Johnson: Biology. 5. Auflage. McGraw-Hill, Boston 1999, S. 1058.
- ↑ Marc Meißner: Arzneimittel in der Umwelt: Natur als Medikamentendeponie. In: Deutsches Ärzteblatt. Nr. 24, 2008, S. A-1324 (aerzteblatt.de).