Aszites


Der Aszites (auch Ascites, von altgriechisch ἀσκίτης askítēs) ist die medizinische Benennung für eine übermäßige Ansammlung von freier, meist klarer seröser Flüssigkeit in der Bauchhöhle, genauer im Peritonealraum; andere Ausdrücke für diese Flüssigkeitsansammlung sind Hydraskos, Bauchwassersucht oder Wasserbauch.
Bei Gesunden enthält der Peritonealraum nur zirka 50 bis 70 Milliliter Flüssigkeit. Bei manchen Krankheiten, z. B. bei einer Leberzirrhose, nimmt die Menge erheblich zu; deswegen sprach man (nach Hippokrates) früher auch von einer Leberwassersucht.[1] Bei einer Mangelernährung mit unzureichender Aufnahme von Proteinen (Kwashiorkor) wird auch vom Hungerbauch gesprochen.
Der bereits in der Antike bekannte Zusammenhang des Aszites mit Lebererkrankungen wurde in den frühen hippokratischen Schriften als durch einen Einschmelzungsvorgang der Leber und später (bei Erasistratos) als zirrhotisch bedingt angesehen.[2][3]
Symptomatik
[Bearbeiten | Quelltext bearbeiten]Kleinere Aszitesmengen sind meist symptomlos. Erst größere Volumina machen sich als Schwellung des Bauches bemerkbar, die meist schmerzlos ist.
Ätiologie und Pathophysiologie
[Bearbeiten | Quelltext bearbeiten]Allen Ursachen gemeinsam ist der Übertritt von Flüssigkeit aus den Blutgefäßen in den Peritonealraum. Der Aszites gehört zusammen mit Hepatischer Enzephalopathie und Ösophagusvarizen zu den lebensbedrohlichen Komplikationen der dekompensierten Leberzirrhose. Mit rund 75 % ist die Leberzirrhose auch die häufigste Ursache für Aszites, da sie durch eine Erhöhung des Drucks im Pfortaderkreislauf zu einem Flüssigkeitsaustritt aus den Blutgefäßen führt. Aszites kann auch bei einem akuten Leberschaden auftreten. Ebenso kann ein Verschluss der venösen Sinus der Leber, z. B. beim Budd-Chiari-Syndrom, zur Bildung von Aszites führen. Auch bei einer Herzinsuffizienz oder einer Pericarditis constrictiva kann es zu Aszites kommen. Tumoren der Leber oder Metastasen im Bauchraum können ebenso eine Flüssigkeitsansammlung bedingen. Bei Perforationen von Hohlorganen führt eine sekundäre Peritonitis (Entzündung des Bauchfells) auch zur Bildung von freier Flüssigkeit im Peritonealraum. Eine Tuberkulose kann solchen Aszites chronisch bedingen. Ebenso kann eine Pankreatitis oder Fisteln des Gallen- oder Pankreassystems zur Bildung von Aszites führen.[4] Bei schwerer Unterernährung kommt es durch Albuminmangel oft zu Aszites. Auch beim Meigs-Syndrom findet sich regelmäßig ein Aszites bei gleichzeitigem Auftreten eines Fibroms des Eierstocks (Ovar) und eines Pleuraergusses.
Diagnostik
[Bearbeiten | Quelltext bearbeiten]

- Körperliche Untersuchung
- Sichtbare Schwellung (ausladende Flanken beim liegenden Patienten, im Gegensatz zum nach oben stehenden Bauch bei Adipositas)
- Perkussion: Dämpfung, die sich entsprechend der Schwerkraft verlagern lässt
- Undulationsphänomen: Bei seitlichem Anstoßen des Bauches bildet sich eine Welle, die (ab etwa zwei Litern Aszitesflüssigkeit) auf der anderen Seite ertastet werden kann.
- Sonografie (Ultraschall): Geringe Mengen von Aszites lassen sich dabei am ehesten am Unterrand der Leber oder knapp oberhalb der Harnblase nachweisen. Der Raum zwischen Leber und Niere (Morison-Grube oder Recessus hepatorenalis) ist im Liegen der tiefste Punkt des Oberbauchs.
- Computertomografie
Um zu klären, warum sich Aszites gebildet hat, ist eine Punktion des Peritonealraums und Untersuchung der Flüssigkeit obligat.
Der Aszites ist meist eine klare Flüssigkeit. Milchiger Aszites weist auf eine Verletzung oder Störung des Lymphabflusses (zum Beispiel durch ein Trauma) hin, kann aber auch bei anderen Erkrankungen vorkommen. Dunkelbrauner Aszites erhält seine Farbe oft durch einen hohen Anteil an Bilirubin und ist hinweisend für ein Galleleck. Schwarzer Aszites kann auf Nekrosen des Pankreas oder ein metastasiertes Melanom hinweisen.[5]
Der Eiweißgehalt des Aszites kann einen Hinweis für die Genese erbringen. Bei einem Eiweißgehalt über 2,5 g/dl (= Exsudat) liegt ein entzündlicher Aszites vor, bei einem Wert unter 2,5 g/dl (= Transsudat) besteht ein nicht-entzündlicher Aszites. Alternativ kann der Albumingehalt des Aszites in Relation zum Albumingehalt des Bluts gesetzt werden. Beträgt dieser Serum-Aszites-Albumin-Gradient (SAAG = Serumalbuminkonzentration minus Aszitesalbuminkonzentration) mehr als 1,1 g/dl, ist von einer Bildung des Aszites durch einen Bluthochdruck in der Pfortader auszugehen. Dabei spricht ein Gradient von 1,1 g/dl bis 2,5 g/dl für das Vorliegen einer Leberzirrhose, der Spätform eines Budd-Chiari-Syndroms oder einer massiven Metastasierung der Leber. Ein auf über 2,5 g/dl erhöhter Gradient spricht für Aszitesbildung im Rahmen einer Herzinsuffizienz oder eines frühen Budd-Chiari-Syndroms. Ein SAAG von kleiner 1,1 g/dl spricht gegen eine Genese des Aszites im Rahmen eines Pfortaderhochdrucks. Dies kann im Rahmen einer Pankreatitis, einer Peritonealkarzinose, eines Gallelecks, einer Tuberkulose oder eines nephrotischen Syndroms auftreten. Eine laborchemische Untersuchung auf Zellzahl kann eine spontan bakterielle Peritonitis nachweisen. Mikrobiologische und zytologische Untersuchungen sind ebenso sinnvoll. Weitere durch hohen Blutdruck in der Pfortader ausgelöste Komplikationen der Leberzirrhose sind Varizenblutungen und die hepatische Enzephalopathie.[5]
Komplikationen
[Bearbeiten | Quelltext bearbeiten]- Refluxösophagitis, Atemnot, Darmwandhernien aufgrund erhöhten intraabdominellen Drucks
- Hydrothorax
- hepatorenales Syndrom
- bei Leberzirrhose erhöhtes Risiko von Varizenblutungen und hepatischer Enzephalopathie
Eine gefährliche Komplikation des Aszites ist die spontan bakterielle Peritonitis (SBP): Bei etwa 15 % der Patienten mit portalem Aszites (also Aszites aufgrund einer Druckerhöhung in der Pfortader wie bei Leberzirrhose) kommt es zu einer Auswanderung von Darmbakterien aus dem Darm mit anschließender Peritonitis. Die häufigsten Erreger sind hierbei Escherichia coli (50 %), grampositive Kokken (30 %) und Klebsiellen (10 %). Die Patienten haben meist weder Fieber noch Abdominalschmerzen, diagnostisch hilft die Aszitespunktion, bei der sich über 250 Granulozyten/µl finden. Der Keimnachweis gelingt oft nicht. Dennoch ist die SBP mit einer hohen Letalität von bis zu 50 % verbunden. Therapie: Cephalosporine der dritten Generation, anschließend Rezidivprophylaxe mit oralem Fluorchinolon.
Eine neuere mikrobiologische Studie widerlegt allerdings die Vermutung, dass die für SBP verantwortlichen Bakterien ausschließlich Mitglieder der Darmflora sind. Außerdem waren Bakterien bereits vor dem Erscheinen der SBP-Symptome nachweisbar. Die genauen Mechanismen, die zu einer Besiedlung des Peritoneums führen, sind daher weitgehend unklar.[6]
Therapie
[Bearbeiten | Quelltext bearbeiten]Medikamentöse Behandlung
[Bearbeiten | Quelltext bearbeiten]Leichte Fälle des Aszites können mit Natriumrestriktion behandelt werden. Etabliert hat sich beim portalen Aszites auch die Gabe von Spironolacton, einem Aldosteronantagonisten. Elektrolyte und Gewicht müssen regelmäßig kontrolliert werden, ebenso sollte man eine Flüssigkeitsbilanz ziehen.
Mittelschwere Fälle werden mit der zusätzlichen Gabe eines Schleifendiuretikums, z. B. Furosemid, behandelt. Die Ausschwemmung sollte schonend erfolgen, d. h. nicht mehr als 500 g Gewichtsabnahme pro Tag, um der Entstehung eines hepatorenalen Syndroms vorzubeugen.
Mechanische Entlastung
[Bearbeiten | Quelltext bearbeiten]
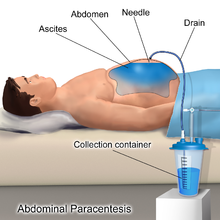
Schwere, therapierefraktäre Verläufe können zusätzlich mit Parazentese, also der Abpunktion der Flüssigkeit, mit gleichzeitiger Albumingabe und anschließender Rezidivprophylaxe mit Diuretika (Medikamente zur Steigerung der Nierenausscheidung) behandelt werden. Bei dieser Methode wird der Erguss durch die Bauchdecke punktiert und abgelassen. Da sich der Aszites meist schnell wieder bildet, muss diese Methode zwangsläufig wiederholt werden. Dies kann vom Arzt zwar ambulant durchgeführt werden, Nachteile sind jedoch dabei, dass bei jeder Wiederholung das Risiko von Blutungen, von bakteriellen Infektionen des Bauchraums und von Verletzungen vorhanden ist.
Es hat sich gezeigt, dass Patienten aufgrund der Schmerzen und Unannehmlichkeiten oft die Punktionen hinauszögern, bis die Symptome unerträglich sind. Als Alternative zu den fortlaufenden Punktionen hat das Legen eines dünnen Ablaufschlauchs (PleurX Aszites) in die Bauchhöhle bewährt. Zwei wissenschaftliche Studien aus den Jahren 2011 und 2013 zeigen als Alternative bei malignem und nicht malignem Aszites die Anlage eines im Unterhautfettgewebe getunnelten Katheters.[7][8] Der im Bauchraum liegende Teil des Silikonschlauches hat mehrere Löcher, über die der Erguss in den Katheter fließen kann. Außerhalb der Bauchhöhle verläuft der Schlauch im Unterhautfettgewebe, um bakterielle Entzündungen zu verhindern. Am Ende des Schlauchs befindet sich ein Ventil, das Eintreten von Luft und das Auslaufen von Flüssigkeit verhindert, wenn keine aktive Entlastung durch den geschulten Patienten oder durch Pflegepersonal stattfindet. Mit dem Ventil ist eine Vakuumflasche verbunden. Wenn die Klemmen an der Flasche geöffnet werden, wird die Flüssigkeit durch den Sog aus dem Bauchraum abgezogen. Die meisten Patienten oder pflegende Angehörige können dies nach einer Einweisung selbst bewerkstelligen.[9] Der Katheter kann ambulant mit örtlicher Betäubung gelegt werden, das Ablassen des Aszites selbst ist schmerzfrei.
Ebenso kann ein TIPS (transjugulärer intrahepatischer portosystemischer (Stent-)Shunt), also eine Verbindung zwischen der Pfortader und der unteren Hohlader, angelegt werden. Hierbei kommt es anschließend allerdings zu einem beinahe ungehinderten Anstrom der normalerweise von der Leber abgebauten Stoffe in den Körperkreislauf. Das bei Leberzirrhose ohnehin in der Entgiftungsfunktion eingeschränkte Organ verliert so die Fähigkeit, Giftstoffe wie Ammoniak zu verstoffwechseln.[10] Dadurch steigt die Gefahr für das Auftreten weiterer Komplikationen, beispielsweise einer portalen Hypertension oder einer hepatischen Enzephalopathie.
Maligner Aszites wird häufig mit wiederholten Parazentesen behandelt. Zudem kommen Shunts und Chemotherapien zum Einsatz, die teilweise direkt in den Peritonealraum (intraperitoneal) verabreicht werden, ebenso wie der speziell für die Therapie des malignen Aszites zugelassene Antikörper Catumaxomab.
Eine weitere Option bei Leberzirrhose ist eine Transplantation. Allerdings stehen nicht ausreichend Organe zur Verfügung. So standen in Deutschland Ende des Jahres 2017 rund 2.000 Patienten auf der Warteliste für eine Lebertransplantation – während nur 823 Patienten tatsächlich eine Spenderleber erhielten.[11]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Ludwig August Kraus: Kritisch-etymologisches medicinisches Lexikon. 3. Auflage. Verlag der Deuerlich- und Dieterichschen Buchhandlung, Göttingen 1844, S. 458.
- ↑ Nikolaus Mani: Die historischen Grundlagen der Leberforschung; I: Die Vorstellungen über Anatomie, Physiologie und Pathologie der Leber in der Antike; II: Die Geschichte der Leberforschung von Galen bis Claude Bernard. (= Basler Veröffentlichungen zur Geschichte der Medizin und der Biologie. 9 und 21). Band I, Basel/Stuttgart 1959 und 1967, S. 50 f. und 80.
- ↑ Matthias Kreienkamp: Das St. Georgener Rezeptar. Ein alemannisches Arzneibuch des 14. Jahrhunderts aus dem Karlsruher Kodex St. Georgen 73. Teil II: Kommentar (A) und textkritischer Vergleich. Medizinische Dissertation. Würzburg 1992, S. 66 und 76 f.
- ↑ A. L. Gerbes, V. Gülberg, T. Sauerbruch, R. Wiest, B. Appenrodt, M. J. Bahr, M. M. Dollinger, M. Rössle, M. Schepke: S3-Leitlinie „Aszites, spontan bakterielle Peritonitis, hepatorenales Syndrom“. In: Z Gastroenterol. Band 49, 2011, S. 749–779.
- ↑ a b Dan L. Longo, Anthony S. Fauci, Dennis L. Kasper, Stephen M. Hauser, J. Larry Jameson: Harrison's Principles of Internal Medicine. 18. Auflage. Band 1, S. 330–333.
- ↑ Geraint B. Rogers, Christopher J. van der Gast u. a.: Ascitic Microbiota Composition Is Correlated with Clinical Severity in Cirrhosis with Portal Hypertension. In: PLoS ONE. 8, 2013, S. e74884, doi:10.1371/journal.pone.0074884.
- ↑ C. R. Tapping, L. Ling, A. Razack: PleurX drain use in the management of malignant ascites: safety, complications, long-term patency and factors predictive of success. In: The British Journal of Radiology. Band 85, 2012, S. 623–628, doi:10.1259/bjr/24538524.
- ↑ Matthew P. Lungren, Charles Y. Kim u. a.: Tunneled Peritoneal Drainage Catheter Placement for Refractory Ascites: Single-center Experience in 188 Patients. In: Journal of Vascular and Interventional Radiology. Band 24, 2013, S. 1303–1308, doi:10.1016/j.jvir.2013.05.042.
- ↑ Heimversorgung von Aszites. Abgerufen am 12. März 2021.
- ↑ K. Grüngreiff: Thieme Refresher Innere Medizin 2014. 1, S. R1–R16.
- ↑ Deutsche Stiftung Organtransplantationen: Jahresbericht 2017; März 2018: 82-83.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- R. Wiest, J. Schölmerich: Diagnostik und Therapie des Aszites. In: Deutsches Ärzteblatt. Band 103, Nr. 28-29, 2006, S. A1972–A1981. (aerzteblatt.de, PDF, 220 kB)
- S3-Leitlinie „Aszites, spontan bakterielle Peritonitis und hepatorenales Syndrom“ der Dt. Ges. f. Verdauungs- und Stoffwechselkrankheiten (DGVS): AWMF-Register Nr. 021/017, Stand 30. April 2011