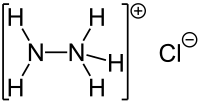
Hydraziniumchlorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hydraziniumchlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | N2H5Cl | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 68,51 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,5 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
240 °C (Zersetzung)[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Hydraziniumchlorid ist eine chemische Verbindung aus der Gruppe der Hydraziniumsalze.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Hydraziniumchlorid bildet sich durch Neutralisation eines Mols Hydrazin mit einem Mol Salzsäure.[3][4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Hydraziniumchlorid ist ein kristalliner farbloser Feststoff, der leicht löslich in Wasser ist. Er zersetzt sich bei Erhitzung über 240 °C, wobei Chlorwasserstoff und Stickstoffoxide entstehen.[1] Die Verbindung besitzt eine orthorhombische Kristallstruktur (a = 1,249 nm, b = 2,185 nm, c = 0,441 nm) mit der Raumgruppe Fdd2 (Raumgruppen-Nr. 43).[2][5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Hydraziniumchlorid wird als Katalysator bei der Synthese von Titanoxid-Polymeren über katalytische Sol-Gel-Verfahren, bei der Herstellung von amorphen Titandioxid-Dünnfilmen mit hohen Brechungsindizes und hoher Transparenz und zur Herstellung von anderen chemischen Verbindungen verwendet.[6] Es kann auch zur Fällung von Elementen wie Gold, Palladium, Platin, Selen und Tellur aus salzsauren Erzlösungen verwendet werden.[7][8]
Verwandte Verbindungen
[Bearbeiten | Quelltext bearbeiten]- Hydraziniumdichlorid N2H6Cl2
- Hydraziniumbromid N2H5Br
- Hydraziniumfluorid N2H5F
- Hydraziniumdifluorid N2H6F2
- Hydraziniumiodid N2H5I
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Eintrag zu Hydraziniumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 199 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Lexikon der Chemie: Hydraziniumchloride, Spektrum der Wissenschaft, abgerufen am 16. November 2016
- ↑ Niels Bjerrum, Ludwig Ebert: Kurzes Lehrbuch der Anorganischen Chemie. Springer-Verlag, 2013, ISBN 978-3-642-91147-7, S. 153 (books.google.de).
- ↑ Sakurai K., Tomiie Y.: The crystal structure of hydrazinium chloride, N2H5Cl. In: Acta Crystallographica. Band 5, Nr. 2, 2. März 1952, doi:10.1107/S0365110X5200085X.
- ↑ Datenblatt Hydrazine monohydrochloride, 97% bei Sigma-Aldrich, abgerufen am 15. November 2016 (PDF).
- ↑ Peter Kurzweil, Paul Scheipers: Chemie Grundlagen, Aufbauwissen, Anwendungen und Experimente. Springer-Verlag, 2011, ISBN 978-3-8348-8280-6, S. 279 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hans Peter Latscha, Gerald W. Linti, Helmut Klein: Analytische Chemie Chemie—Basiswissen III. Springer-Verlag, 2013, ISBN 978-3-642-18493-2, S. 95 (eingeschränkte Vorschau in der Google-Buchsuche).



