Hydrochlorothiazid
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Hydrochlorothiazid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
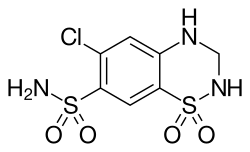
| Summenformel | C7H8ClN3O4S2 | |||||||||||||||||||||
| Kurzbeschreibung |
Weißes bis fast weißes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 297,74 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
7,9[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Hydrochlorothiazid (HCT oder auch HTZ genannt) ist eine harntreibende Substanz aus der Gruppe der Thiazid-Diuretika, als deren Prototyp es gilt. Es wird bei Bluthochdruck, Herzinsuffizienz oder zur Ausschwemmung von Ödemen angewandt, häufig in Form fixer Kombinationen mit weiteren Wirkstoffen (vgl. Handelspräparate).
Chemie
[Bearbeiten | Quelltext bearbeiten]Die heterocyclische Verbindung 6-Chlor-7-sulfamyl-3,4-dihydro-1,2,4-benzothiadiazin-1,1-dioxid wurde in den späten 1950er Jahren von Forschern der US-amerikanischen Tochtergesellschaft der schweizerischen Ciba in Summit (New Jersey) entwickelt[4] und 1958 in der Zeitschrift Experientia als hochwirksames Diuretikum beschrieben.[5] Eine Herstellung wurde durch verschiedene Patente geschützt, u. a. US-Patent 3163645 (de Stevens, Werner, 1964). Wie der Trivialname des Arzneistoffes zum Ausdruck bringt, kann die Verbindung als hydrierte Form von Chlorothiazid betrachtet werden, das von der Firma Merck & Co. (USA) als Diuretikum und Blutdrucksenker entwickelt worden war. Die Herstellung von Hydrochlorothiazid und verwandter Verbindungen wird im US-Patent 3025292 beschrieben.
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Wirkmechanismus
[Bearbeiten | Quelltext bearbeiten]Als Thiazid hemmt Hydrochlorothiazid reversibel den Natrium-Chlorid-Kotransporter in der luminalen Zellmembran der Zellen des distalen Tubulus in der Niere, wodurch Natriumchlorid samt dazugehörigem Lösungswasser ausgeschieden wird. Weiterhin nimmt die renale Ausscheidung von Calcium-Kationen ab und die von Magnesium-Kationen zu.[6] Die gesteigerte Calcium-Retention kann zu einer Zunahme der Knochendichte bei Osteoporose-Patienten führen, was vorteilhaft ist.
Hydrochlorothiazid wirkt in hohen Dosierungen auch auf das Enzym Carboanhydrase hemmend, doch besitzt es lediglich ein Zehntel[7] der für Carboanhydrasehemmer üblichen inhibitorischen Potenz, und hat – wie andere Thiazide auch – eine flache Dosis-Wirkungs-Kurve, was heißt, dass auch bei enormer Dosissteigerung nur eine minimale Steigerung der weiteren Effektivität erreicht wird. Hydrochlorothiazid sollte in der Schwangerschaft vermieden werden.
Pharmakokinetik
[Bearbeiten | Quelltext bearbeiten]Die Bioverfügbarkeit von Hydrochlorothiazid beträgt 70 %,[6] die Plasmaproteinbindung 95 %, seine Wirkungsdauer 6–12 Stunden. Es wird größtenteils (92 ± 5 %) unverändert über die Niere ausgeschieden und hat eine Plasmahalbwertszeit von 1,3 bis 1,7 Stunden.[8]
Diuretika – u. a. Thiaziddiuretika wie Hydrochlorothiazid – führen über den Elektrolyt- und Flüssigkeitsverlust zu einer Aktivierung des RAAS und damit zum sekundären Hyperaldosteronismus.
Analytik
[Bearbeiten | Quelltext bearbeiten]Zur sicheren qualitativen und quantitativen Bestimmung von Hydrochlorothiazid kann die Kopplung von HPLC und Massenspektrometrie nach adäquater Probenvorbereitung verwendet werden.[9][10] Die Methodik wird auch eingesetzt, um Verfälschungen von Arzneimitteln nachzuweisen.[11]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Beschreibung der Nebenwirkungen nach Häufigkeit:
Häufig: Störungen im Flüssigkeits- und Elektrolythaushalt (insbesondere zu vermindertem Kalium- und Natriumspiegel (Hypokaliämie und Hyponatriämie)), verminderte Magnesium- und Chloridspiegel, erhöhter Kalziumspiegel im Blut (Hypomagnesiämie, Hypochlorämie, Hyperkalzämie), Mundtrockenheit und Durst (bei hoher Dosierung, Schwäche- und Schwindelgefühl, Muskelschmerzen und Muskelkrämpfe, z. B. Wadenkrämpfe), Kopfschmerzen, Nervosität, Herzklopfen, verminderter Blutdruck (Hypotonie), Kreislaufstörungen mit vermindertem Blutdruck (beim Wechsel vom Liegen zum Stehen: orthostatische Regulationsstörungen); bei exzessiver Harnausscheidung kann es infolge „Entwässerung“ (Dehydratation) und verminderter zirkulierender Blutmenge (Hypovolämie) zur Bluteindickung (Hämokonzentration), sowie als Folge der Hämokonzentration – insbesondere bei älteren Patienten oder bei Vorliegen von Venenerkrankungen – zu Thrombosen und Embolien kommen. Infolge einer Hypokaliämie können Müdigkeit, Schläfrigkeit, Muskelschwäche, Missempfindungen an den Gliedmaßen (Parästhesien), Lähmungen (Paresen), Teilnahmslosigkeit (Apathie), Adynamie der glatten Muskulatur mit Verstopfung und übermäßige Gasansammlung im Magen-Darm-Trakt (Meteorismus) oder Herzrhythmusstörungen auftreten. Verstärkte Magnesiumausscheidungen im Harn (Hypermagnesiurien) sind häufig und äußern sich nur gelegentlich im Blut als Magnesiummangel (Hypomagnesimien). Gichtanfälle (durch erhöhten Harnsäurespiegeln im Blut Hyperurikämie), erhöhter Blutzuckerspiegel (Hyperglykämie), vermehrte Ausscheidung von Zucker im Urin (Glukosurie), Anstieg der Blutfette (Cholesterin, Triglyzeride).
Gelegentlich: Anstieg der harnpflichtigen Substanzen (Kreatinin, Harnstoff), erhöhte Amylasewerte im Blut (Hyperamylasämie), Entzündung der Bauchspeicheldrüse (Pankreatitis), Appetitlosigkeit und Magen-Darm-Beschwerden (bw. Übelkeit, Erbrechen, Diarrhö, Schmerzen und Krämpfe im Bauchraum)
Selten: allergische Hautreaktionen (z. B.: Juckreiz, Hautrötung, Exantheme durch Lichteinwirkung, kleinfleckige Einblutungen in Haut und Schleimhaut (Purpura), stark juckende Quaddeln (Urtikaria)), Arzneimittelfieber oder eine Gelbsucht (Ikterus), akute Nierenentzündung (interstitielle Nephritis), Gefäßentzündung (Vaskulitis), Verminderung der weißen Blutkörperchen (Leukopenie), Verminderungen der Blutplättchen (Thrombozytopenie), eine Anämie durch Blutbildungsstörung im Knochenmark (aplastische Anämie), Potenzstörungen, geringgradige Sehstörungen (bspw.: verschwommenes Sehen, Farbsehstörungen, Gelbsehen), Einschränkung der Bildung von Tränenflüssigkeit, bestehende Kurzsichtigkeit kann sich verschlimmern.[12]
Im Oktober 2018 informierten die Zulassungsinhaber via Rote-Hand-Brief darüber, dass pharmakoepidemiologische Studien ein erhöhtes Risiko für das Auftreten eines Basalzellkarzinoms (Basaliom, weißer Hautkrebs) oder Plattenepithelkarzinoms (Spinaliom) bei Exposition mit steigenden kumulativen Dosen von Hydrochlorothiazid aufgezeigt haben. Es wurde die Empfehlung ausgesprochen, dass Patienten, die mit Hydrochlorothiazid behandelt werden, sich regelmäßig auf Hautveränderungen untersuchen lassen und verdächtige Veränderungen „gegebenenfalls einschließlich einer histologischen Untersuchung von Biopsien“ überprüft werden sollten. Für Patienten, die bereits an den genannten Hauterkrankungen erkrankt waren, „kann es notwendig sein, den Einsatz von HCT erneut sorgfältig abzuwägen“.[13]
Verwendung im Doping
[Bearbeiten | Quelltext bearbeiten]Hydrochlorothiazid steht auf der Verbotsliste der Welt-Antidoping-Agentur.[14] Obwohl es nicht direkt der Leistungssteigerung dient, kann es zur Verschleierung solcher Dopingmittel herangezogen werden, es wird daher als Maskierungsmittel bezeichnet.
Studienlage
[Bearbeiten | Quelltext bearbeiten]Hydrochlorothiazid wird als Blutdrucksenker meist erst eingesetzt, wenn mit einem anderen Wirkstoff allein keine ausreichende Blutdrucksenkung zu erzielen ist und zwei Wirkstoffe notwendig sind. Die Empfehlung zur zusätzlichen Verordnung von Hydrochlorothiazid unter dieser Bedingung wird auf die Ergebnisse der MRFIT-Studie zurückgeführt, bei der vier verschiedene Blutdrucksenker unter genau dieser Fragestellung getestet wurden. Drei Wirkstoffe schnitten am Ende gleich gut ab, die Testung mit dem vierten – Hydrochlorothiazid – wurde aber vorzeitig abgebrochen, da eine erhöhte kardiovaskuläre Sterblichkeit zu verzeichnen war. Spätere Analysen der MRFIT-Studie bestätigen diese Beobachtung und führen sie u. a. auf vermehrte Herzrhythmusstörungen, aber auch die schlechtere Blutdrucksenkung und schwächere Rückbildung der linksventrikulären Hypertrophie zurück.[15][16] Dennoch wird in heutigen Leitlinien die Aussage der Autoren bezüglich der drei erfolgreichen Wirkstoffe auch auf den vierten, gescheiterten – also Hydrochlorothiazid – übertragen.
Der Effekt von HCT auf den Blutdruck ist im Vergleich zu anderen Diuretika als Monotherapie (z. B. Chlortalidon) auch in anderen Studien schwächer.[17][18] In Kombinationspräparaten (z. B. mit einem AT1-Antagonisten) schneidet HCT (im Vergleich zu anderen Kombinationspräparaten mit anderen Diuretika) vergleichbar[19] oder unterlegen[20] ab. Bezüglich der Prävention von Schlaganfällen scheint HCT aber Vorteile zu bringen.[21]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate: Disalunil (D), Esidrex (CH), Esidrix (D), zahlreiche Generika (D)
- mit Aliskiren: Rasilez HCT (D, A, CH)
- mit Amilorid: Comilorid (CH), Diursan (D), Ecodurex (CH), Escoretic (CH), Loradur (A), Moduretic (A, CH), Rhefluin (CH)
- mit Benazepril: Cibadrex (D, CH), zahlreiche Generika (D)
- mit Bisoprolol: Bilol comp. (CH), Concor plus (D, CH), Rivacor plus (A), Lodoz (CH), zahlreiche Generika (D)
- mit Candesartan: Atacand plus (D, A, CH), Blopress plus (D, A, CH), zahlreiche Generika (D)
- mit Captopril: ACE-Hemmer (D), Adocomp (D), Capozide forte (A), Cardiagen (D), Jutacor comp. (D), Tensobon comp. (D), zahlreiche Generika (D)
- mit Cilazapril: Dynorm Plus (D), Inhibace Plus (CH)
- mit Enalapril: Co-Acepril (CH), Co-Reniten (CH), Coenytyrol (A), Corvo HCT (D), Elpradil HCT (CH), Renacor (D), Renitec plus (A, CH), zahlreiche Generika (D)
- mit Eprosartan: Emestar plus (D), Teveten plus (D, A, CH)
- mit Fosinopril: Dynacil comp. (D)
- mit Irbesartan: CoAprovel (D, A, CH), Karvezide (D, A)
- mit Lisinopril: Acecomp (A), Acercomp (D), Co-Lisinostad (A), Co-Lisinopril (A), Prinzide (CH), Zestoretic (CH), zahlreiche Generika (D)
- mit Losartan: Cosaar Plus (CH), Fortzaar (A), Lanosar comp. (A), Lorzaar plus (D), Losathia (A), zahlreiche Generika (D)
- mit Metoprolol:Beloc-ZOK comp. (D), Seloken retard plus (A), zahlreiche Generika (D)
- mit Nebivolol: Hypoloc plus HCT, (A), Nomexor plus HCT (A)
- mit Olmesartan: Olmetec (D, A, CH), Votum plus (D, CH)
- mit Quinalapril: Accuzide (D, A, CH)
- mit Ramipril: Delix plus (D), Lannapril plus (A), Triatec comp. (CH), Tritazide (A), Vesdil plus (D), zahlreiche Generika (D)
- mit Spironolacton: Spironothiazid (D)
- mit Telmisartan: Kinzalkomb (D, A, CH), Micardis plus (D, A, CH), Pritor plus (A)
- mit Triamteren: Diuretikum Verla (D), Diu Venostasin (D), Dytide H (D, A), Nephral (D), Tri-Thiazid (D), Turfa gamma (D)
- mit Valsartan: Co-Diovan (D, A, CH), Cordinate (D), Provas (D), zahlreiche Generika (D)
- mit Verapamil: Isoptin RR plus (D)
- mit Zofenopril: Bifril plus (A)
als Zweifach-Kombination:
- mit Amilorid + Timolol: Moducrin (D)
- mit Amlodipin + Valsartan: Dafiro HCT (D), Exforge HCT (D, CH)
- mit Amlodipin + Ramipril: Tonotec HCT (D)
- mit Atenolol + Amilorid: Kalten (CH)
- mit Propranolol + Triamteren: Beta-Turfa gamma (D), Dociteren (D)
- mit Triamteren + Verapamil: Confit (A)
Umweltrelevanz
[Bearbeiten | Quelltext bearbeiten]Für Hydrochlorothiazid ist bislang keine ökotoxikologische Wirkung nachgewiesen. Es ist in Kläranlagen schlecht abbaubar.[22] Hydrochlorothiazid ist eine der Leitchemikalien der Schweizer Kontrollliste für die Einschätzung der Klärleistung in der 4. Reinigungsstufe.[23]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Arzneimittelkompendium der Schweiz: Hydrochlorothiazid-Präparate
Literatur
[Bearbeiten | Quelltext bearbeiten]- Ernst Mutschler: Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie; mit einführenden Kapiteln in die Anatomie, Physiologie und Pathophysiologie. 8. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2001, ISBN 3-8047-1763-2, S. 585–586.
- Heinz Lüllmann, Klaus Mohr, Lutz Hein: Taschenatlas Pharmakologie. 5. Auflage. Georg Thieme Verlag, Stuttgart 2004, ISBN 3-13-707705-2, S. 168–169.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Europäische Arzneibuch-Kommission (Hrsg.): Europäische Pharmakopöe 5. Ausgabe. Band 5.0–5.8, 2006.
- ↑ a b c d e Eintrag zu Hydrochlorothiazide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Datenblatt Hydrochlorothiazide bei Sigma-Aldrich, abgerufen am 16. Juni 2011 (PDF).
- ↑ Jie Jack Lee: History of Drug Discovery. In: Jie Jack Li, E. J. Corey (Hrsg.): Drug Discovery: Practices, Processes, and Perspectives. John Wiley & Sons, 2013, S. 12. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ G. de Stevens, L. H. Werner, A. Halamandaris und S. Ricca Jr.: Dihydrobenzothiadiazine dioxides with potent diuretic effect. In: Experientia 14, 463 (1958), doi:10.1007/BF02327380.
- ↑ a b Eduard Burgis: Intensivkurs Allgemeine und spezielle Pharmakologie. 3. Auflage. Urban und Fischer (Elsevier), München 2004, ISBN 978-3-437-42613-1, S. 186–188.
- ↑ Comprehensive Heterocyclic Chemistry. 1, S. 173–174.
- ↑ Thomas Küttler: Kurzlehrbuch Allgemeine Pharmakologie und Toxikologie. 18. Auflage. Urban und Fischer (Elsevier), München 2002, ISBN 978-3-437-41041-3, S. 163.
- ↑ NV Ramakrishna, KN Vishwottam, S Manoj, M Koteshwara, S Wishu, DP Varma: Sensitive liquid chromatography-tandem mass spectrometry method for quantification of hydrochlorothiazide in human plasma. In: Biomed Chromatogr., 2005 Dec, 19(10), S. 751–760, PMID 15856489
- ↑ JR Patel, TM Pethani, AN Vachhani, NR Sheth, AV Dudhrejiya: Development and validation of bioanalytical method for simultaneous estimation of ramipril and hydrochlorothiazide in human plasma using liquid chromatography-tandem mass spectrometry. In: J Chromatogr B Analyt Technol Biomed Life Sci., 2014 Nov 1, 970, S. 53–59, PMID 25240204
- ↑ M Bernard, W Akrout, CT Van Buu, C Metz, M Antignac, N Yagoubi, B Do: Liquid chromatography with tandem mass spectrometry for the simultaneous identification and quantification of cardiovascular drugs applied to the detection of substandard and falsified drugs. In: J Sep Sci., 2015 Feb, 38(4), S. 562–570, PMID 25521603
- ↑ Gebrauchsinformation zu HCT-beta der Firma beta-pharm Arzneimittel GmbH, Augsburg (6/2008).
- ↑ media.gelbe-liste.de: Hydrochlorothiazid - Risiko von nichtmelanozytärem Hautkrebs (PDF; 2,7 MB)
- ↑ Der Welt-Anti-Doping-Code. Die Verbotsliste 2011 (internationaler Standard). (PDF; 125 kB) Nationale Anti-Doping-Agentur, Bonn.
- ↑ P Kezdi, PC Kezdi, HJ. Khamis: Diuretic induced long term hemodynamic changes in hypertension. A retrospective study in a MRFIT clinical center. In: Clin Exp Hypertens A, 1992, 14(3), S. 347–365.
- ↑ Michael E. Ernst, James D. Neaton, Richard H. Grimm, Gary Collins, William Thomas, Elsayed Z. Soliman, Ronald J. Prineas, Multiple Risk Factor Intervention Trial Research Group: Long-term effects of chlorthalidone versus hydrochlorothiazide on electrocardiographic left ventricular hypertrophy in the multiple risk factor intervention trial. In: Hypertension (Dallas, Tex.: 1979). Band 58, Nr. 6, Dezember 2011, S. 1001–1007, doi:10.1161/HYPERTENSIONAHA.111.181248, PMID 22025372, PMC 3245686 (freier Volltext).
- ↑ Michael E. Ernst, Barry L. Carter, Chris J. Goerdt, Jennifer J. G. Steffensmeier, Beth Bryles Phillips, M. Bridget Zimmerman, George R. Bergus: Comparative antihypertensive effects of hydrochlorothiazide and chlorthalidone on ambulatory and office blood pressure. In: Hypertension (Dallas, Tex.: 1979). Band 47, Nr. 3, März 2006, S. 352–358, doi:10.1161/01.HYP.0000203309.07140.d3, PMID 16432050.
- ↑ Anil K. Pareek, Franz H. Messerli, Nitin B. Chandurkar, Shruti K. Dharmadhikari, Anil V. Godbole, Prasita P. Kshirsagar, Manish A. Agarwal, Kamal H. Sharma, Shyam L. Mathur, Mukund M. Kumbla: Efficacy of Low-Dose Chlorthalidone and Hydrochlorothiazide as Assessed by 24-h Ambulatory Blood Pressure Monitoring. In: Journal of the American College of Cardiology. Band 67, Nr. 4, 2. Februar 2016, S. 379–389, doi:10.1016/j.jacc.2015.10.083, PMID 26821625.
- ↑ Anil Pareek, Hathur Basavanagowdappa, Shyamsundar Zawar, Anil Kumar, Nitin Chandurkar: A randomized, comparative study evaluating the efficacy and tolerability of losartan-low dose chlorthalidone (6.25 mg) combination with losartan-hydrochlorothiazide (12.5 mg) combination in Indian patients with mild-to-moderate essential hypertension. In: Expert Opinion on Pharmacotherapy. Band 10, Nr. 10, Juli 2009, S. 1529–1536, doi:10.1517/14656560902991514, PMID 19514864.
- ↑ Joel M. Neutel, William C. Cushman, Eric Lloyd, Bruce Barger, Alison Handley: Comparison of long-term safety of fixed-dose combinations azilsartan medoxomil/chlorthalidone vs olmesartan medoxomil/hydrochlorothiazide. In: Journal of Clinical Hypertension (Greenwich, Conn.). Band 19, Nr. 9, September 2017, S. 874–883, doi:10.1111/jch.13009, PMID 28681550, PMC 8031288 (freier Volltext).
- ↑ WE. Miall: Beta-blockers vs. thiazides in the treatment of hypertension: a review of the experience of the large national trials. In: J Cardiovasc Pharmacol, 1990, 16 Suppl 5, S. 58–63.
- ↑ [ https://www.cee.ed.tum.de/fileadmin/w00cbe/sww/pdf/Schlussbericht_PP4_Weissenburg.pdf LfU - Pilotprojekt 4. Reinigungsstufe auf der Kläranlage Weißenburg, Erfahrungen im Regelbetrieb, 2021], abgerufen am 21. Juli 2024
- ↑ Die Publikationsplattform des Bundesrechts - Verordnung des UVEK zur Überprüfung des Reinigungseffekts von Massnahmen zur Elimination von organischen Spurenstoffen bei Abwasserreinigungsanlagen, Stand 1. Dezember 2016, abgerufen am 21. Juli 2024