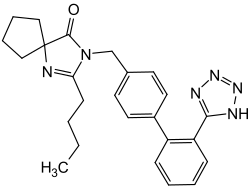
Irbesartan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Irbesartan | |||||||||||||||||||||
| Andere Namen |
2-Butyl-3-({4-[2-(2H-1,2,3,4-tetrazol-5-yl)phenyl]phenyl}methyl)-1,3-diazaspiro[4.4]non-1-en-4-on (IUPAC) | |||||||||||||||||||||
| Summenformel | C25H28N6O | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 428,54 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Irbesartan ist ein Arzneistoff aus der Gruppe der AT1-Antagonisten, der in der Behandlung von Bluthochdruck und leichter bis mittelschwerer Herzinsuffizienz, falls eine ACE-Hemmer-Therapie ungeeignet ist, eingesetzt wird.
Anwendungsgebiete (Indikationen)
[Bearbeiten | Quelltext bearbeiten]Irbesartan wird für die Behandlung folgender Krankheiten eingesetzt:[3]
- Essentielle Hypertonie
- Nierenerkrankung bei Patienten mit Hypertonie und Typ-2-Diabetes mellitus als Teil einer antihypertensiven Behandlung.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Die mehrstufige Synthese von Irbesartan geht vom Cyclopentanon aus, wobei im ersten Schritt durch die Umsetzung mit Natriumcyanid und Ammoniak das 1-Amino-1-cyclopentancarbonitril erhalten wird. Über eine Amidbildung mit Pentansäurechlorid und anschließende basische Zyklisierung wird eine Spirozwischenverbindung gebildet. Anschließend wird in Gegenwart von Natriumhydrid und Dimethylformamid mit 4′-(Brommethyl)-biphenyl-2-carbonitril die Biphenylsubstruktur in das Molekül eingefügt. Im letzten Syntheseschritt wird mittels Natriumazid durch Bildung der Tetrazolfunktion aus der Cyanogruppe die Zielverbindung erhalten.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Verbindung tritt in zwei polymorphen Kristallformen auf.[1]
-
Irbesartan, Polymorph A
-
Irbesartan, Polymorph B
Das Polymorph A schmilzt bei 181 °C mit einer Schmelzenthalpie von 91 J·g−1, Polymorph B bei 186 °C mit 116 J·g−1.[1] Beide Formen stehen monotrop zueinander. Das Polymorph B ist die thermodynamisch stabile Kristallform. Die beiden polymorphen Kristallformen unterscheiden sich hinsichtlich der Tautomerie der Tetrazolstruktur. Polymorph A entspricht der 4H-Tetrazolstruktur, Polymorph B der 2H-Tetrazolstruktur.[5][6] Das Polymorph A kristallisiert in einem hexagonalen Kristallsystem, das Polymorph B dagegen in einem triklinen Kristallsystem.[1]
Krebsgefährdende Verunreinigungen
[Bearbeiten | Quelltext bearbeiten]Aufgrund von Verunreinigungen mit dem potentiell krebserregenden N-Nitrosodiethylamin (NDEA) beim Wirkstoffhersteller Aurobindo Pharma Limited aus Hyderabad gab es seit Oktober 2018 mehrere Rückrufe Irbesartan-haltiger Medikamente.[7]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Aprovel
Umweltrelevanz
[Bearbeiten | Quelltext bearbeiten]Wie mehrere andere Sartane zersetzt sich Irbesartan unter Bildung der sehr persistenten und sehr mobilen Valsartansäure. Sie stellt ein Problem für die Trinkwassergewinnung dar, da sie sich bei der konventionelle Abwasserbehandlung nicht zersetzt und sich so in Gewässern und im Grundwasser bis zum Gesundheitlichen Orientierungswert (GOW im Trinkwasser = 0,3 μg/L) anreichert. Selbst bei einer Behandlung mittels der sogenannten 4. Reinigungsstufe werden bei Ozonverfahren nur bis zu 39 und mittels Aktivkohle bis zu 41 % eliminiert.[8] Irbesartan ist eine der Leitchemikalien der Schweizer Kontrollliste für die Einschätzung der Klärleistung in der 4. Reinigungsstufe.[9]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e N. Boutonnet-Fagegaltier, J. Menegotto, A. Lamure, H. Duplaa, A. Caron, C. Lacabanne, M. Bauer: Molecular Mobility Study of Amorphous And Crystalline Phases of a Pharmaceutical Product by Thermally Stimulated Current Spectrometry. In: J Pharm Sci. Band 91, 2002, S. 1548–1560, doi:10.1002/jps.10146.
- ↑ a b Datenblatt Irbesartan, European Pharmacopoeia (EP) Reference Standard bei Sigma-Aldrich, abgerufen am 1. November 2016 (PDF).
- ↑ ROTE LISTE 2013. 53. Ausgabe. Verlag Rote Liste Service, Frankfurt am Main, ISBN 978-3-939192-70-1, S. 662.
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dieter Reichert: Pharmaceutical Substances. 4. Auflage. 2 Bände. Thieme-Verlag, Stuttgart 2000, ISBN 1-58890-031-2; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- ↑ M. Bauer, R. K. Harris, R. C. Rao, D. C. Apperley, C. A. Rodger: NMR study of desmotropy in irbesartan, a tetrazole-containing pharmaceutical compound. In: J. Chem. Soc. Perkin Trans. 1998, S. 475–481.
- ↑ Z. Böcskei, K. Simon, R. C. Rao, A. Caron, C. A. Rodger, M. Bauer: Irbesartan crystal form B. In: Acta Cryst. C 54, 1998, S. 808–810.
- ↑ NDEA: Zweiter Irbesartan-Rückruf, erstes Irbesartan-CEP zurückgezogen. In: Deutsche Apotheker Zeitung. 11. Oktober 2018.
- ↑ Umweltbundesamt – Kurzdossier Spurenstoffe von Valsartansäure, Seite 1 ,3 und 4, Stand Januar 2023, abgerufen am 7. Juli 2024
- ↑ Die Publikationsplattform des Bundesrechts - Verordnung des UVEK zur Überprüfung des Reinigungseffekts von Massnahmen zur Elimination von organischen Spurenstoffen bei Abwasserreinigungsanlagen, Stand 1. Dezember 2016, abgerufen am 21. Juli 2024