Iodierung (Chemie)
Unter Iodierung versteht man in der organischen Chemie die Einführung von Iod mit Hilfe von Iodierungsmitteln in Form einer Addition bzw. Substitution. Sie ist ein Spezialfall der Halogenierung.
Iodierungsmittel
[Bearbeiten | Quelltext bearbeiten]Als Iodierungsmittel kommen unter anderem folgende Stoffe bzw. Stoffgruppen zum Einsatz:
- elementares Iod oder die equimolare wässrige Lösung von Iod und Kaliumiodid in Wasser (Bildung von I3−-Ionen)
- Iodwasserstoffsäure
- Iodmonochlorid
- N-Iodacetamid
- N-Iodsuccinimid
- 1,3-Diiod-5,5-dimethylhydantoin
- Bis-sym-collidino-iodoniumperchlorat
- Natriumiodid oder Kaliumiodid
- Phosphortriiodid
- Säureiodide
Substitution
[Bearbeiten | Quelltext bearbeiten]Eine übliche Methode zur Herstellung, auch im großtechnischen Maßstab, ist die Umsetzung von Alkoholen mit Iodwasserstoffsäure. Dabei wird die Hydroxy-Gruppe von der Säure protoniert und das Kohlenstoffatom kann dann entweder so leicht vom Iodid-Ion angegriffen werden (SN2-Mechanismus) oder aber es erfolgt eine Abspaltung von Wasser unter Bildung eines Carbokations, welches dann vom Iodid-Ion angegriffen werden kann (SN1-Mechanismus).[1] Aromatische Hydroxy-Gruppen (Phenole) können auf diese Weise nicht iodiert werden.
Addition
[Bearbeiten | Quelltext bearbeiten]Elementares Iod addiert wie auch Brom elektrophil an Alkene. Die Ausbeuten sind jedoch in der Regel gering aufgrund der höheren Reaktivität der vicinalen Diiodide. Ein Spezialfall hingegen ist die Iodlactonisierung von Allylestern, die in guten Ausbeuten bei der Umsetzung mit elementarem Iod das Iodlacton bilden. Hier wird das hochreaktive geminale Diiodid nicht gebildet, weil das Iodonium-Ion direkt vom Estercarbonyl-Sauerstoffatom nucleophil und intramolekular geöffnet wird.[1]
Finkelstein-Reaktion
[Bearbeiten | Quelltext bearbeiten]Durch die Finkelstein-Reaktion lassen sich die Halogen-Atome von Alkylchloriden oder -bromiden in acetonischer Lösung mit Hilfe von Natriumiodid in die entsprechenden Alkyliodide überführen („Halogenaustauschreaktion“). Das Gleichgewicht dieser Reaktion wird durch die Bildung von in Aceton unlöslichen Bromiden oder Chloriden auf die Seite des Alkyliodides verschoben.
Iodierung von Aromaten
[Bearbeiten | Quelltext bearbeiten]Viele Aromatische Kohlenwasserstoffe lassen sich nicht ohne Weiteres direkt elektrophil iodieren, da Iod kein gutes Elektrophil ist. Aromatische Heterocyclen lassen sich hingegen häufig sehr leicht und sehr regiospezifisch iodieren.
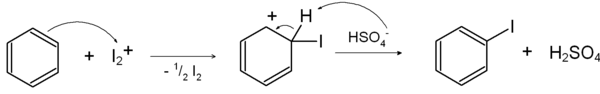
Die direkte Iodierung aus dem unsubstituierten Aromaten gelingt jedoch in Gegenwart von Oleum, Salpetersäure oder Quecksilber(II)-oxid, die elementares Iod zum stärkeren Elektrophil I2+ oxidieren:[2]
Die anschließende Iodierung geht wie folgt vor sich:[3]
Die Synthese von iodierten Aromaten kann auch durch eine sandmeyer-ähnliche Reaktion erfolgen, z. B. kann Iodbenzol durch Diazotierung von Anilin und anschließende Zugabe einer Iodid-Lösung hergestellt werden.[4]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Autorenkollektiv: Organikum. 22. Auflage. Wiley-VCH, 2004, ISBN 978-3527311484.
- ↑ F. B. Dains, R. Q. Brewster: Iodobenzene In: Organic Syntheses. 9, 1929, S. 46, doi:10.15227/orgsyn.009.0046; Coll. Vol. 1, 1941, S. 323 (PDF).
- ↑ Paula Y. Bruice, Organische Chemie, Pearson Studium, 5. Aufl., S. 755, ISBN 978-3-8273-7190-4.
- ↑ H. J. Lucas, E. R. Kennedy: Iodobenzene In: Organic Syntheses. 19, 1939, S. 55, doi:10.15227/orgsyn.019.0055; Coll. Vol. 2, 1943, S. 351 (PDF).
Quellen
[Bearbeiten | Quelltext bearbeiten]- H. Beyer, W. Walter: Lehrbuch der Organischen Chemie. 20. Aufl., Hirzel, Stuttgart, 1984. S. 446.
- Eintrag zu Iodierung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2015.