Kaliumhexafluoroantimonat(V)
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ K+ _ Sb5+ _ F− | |||||||||||||||||||
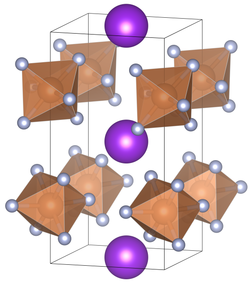
| Kristallsystem |
tetragonal | ||||||||||||||||||
| Raumgruppe |
P42m (Nr. 111) | ||||||||||||||||||
| Gitterparameter |
a = 5,16 Å, c = 10,07 Å[1] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumhexafluoroantimonat(V) | ||||||||||||||||||
| Verhältnisformel | K[SbF6] | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 274,85 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
846 °C[4] | ||||||||||||||||||
| Siedepunkt |
1505 °C[4] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Kaliumhexafluoroantimonat, K[SbF6] ist eine anorganische Verbindung zwischen dem Alkalimetall Kalium und der Supersäure Hexafluorantimonsäure.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Kaliumhexafluoroantimonat kann durch Reaktion von Kaliumpyroantimonat K2H2Sb2O7 mit Fluorwasserstoff oder durch Behandlung des Produkts der Reaktion einer Mischung aus festem Antimon(III)-oxid und Kaliumhydroxid mit Wasserstoffperoxid-Lösung (30 %) mit Salzsäure (48 %) dargestellt werden. Die Verbindung kann auch durch Behandlung einer äquimolaren Mischung aus Antimon(V)-chlorid und Kaliumchlorid (oder Kaliumfluorid) mit einem Überschuss an wasserfreiem Fluorwasserstoff bei hohen Temperaturen und Drücken synthetisiert werden.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Kaliumhexafluoroantimonat ist ein geruchsloses, weißes Pulver. Es lässt sich in Wasser lösen.[3][5] Kaliumhexafluoroantimonat kristallisiert in Abhängigkeit von der Temperatur in einer tetragonalen (Koordinationszahl der A-Position = 8) mit der Raumgruppe P42m (Raumgruppen-Nr. 111)[1] und einer kubischen (Koordinationszahl der A-Position = 6) Variante mit der Raumgruppe Ia3 (Raumgruppen-Nr. 206).[7][8] Die Verbindung unterzieht sich bei 16 °C einem Übergang von einer kubischen zur tetragonalen Kristallstruktur.[6] Bei hohem Druck ist eine weitere Kristallstruktur bekannt.[9]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Kaliumhexafluoroantimonat wird als pharmazeutisches Zwischenprodukt verwendet.[5]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Die Verbindung wirkt beim Verschlucken oder Inhalieren giftig.[3]
Das Salz kann heftige Reaktionen mit starken Säuren und Oxidationsmitteln hervorrufen.[3][4] Bei der Verbrennung des Stoffes kann Fluorwasserstoff, Kaliumoxid und Antimonoxide entstehen.[2][4][5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b G. J. Kruger, C. W. F. T. Pistorius, A. M. Heyns: Potassium hexafluoroantimonate (I). In: Acta Crystallographica Section B. B32, 1976, S. 2916–2918, doi:10.1107/S0567740876009230 (Open Access).
- ↑ a b Datenblatt Potassium hexafluoroantimonate bei ApolloScientific, abgerufen am 16. Februar 2019 (PDF).
- ↑ a b c d Datenblatt Potassium hexafluoroantimonate(V) bei Sigma-Aldrich, abgerufen am 16. Februar 2019 (PDF).
- ↑ a b c d Datenblatt Potassium hexafluoroantimonate(V) bei Santa Cruz Biotechnology, abgerufen am 16. Februar 2019 (PDF).
- ↑ a b c d e f Datenblatt Potassium hexafluoroantimonate bei Alfa Aesar, abgerufen am 16. Februar 2019 (Seite nicht mehr abrufbar).
- ↑ a b Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 3217 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Caroline Röhr, Rüdiger Kniep: Die Kristallstrukturen von Li[PF6] und Li[AsF6]: Zur Kristallchemie von Verbindungen A[EVF6]. In: Zeitschrift für Naturforschung B. 49, 1994, S. 650–654 (PDF, freier Volltext).
- ↑ Hans Bode, Ernst Voss: Die Kristallstruktur des Kaliumhexafluoroantimonats (V). In: Zeitschrift für anorganische und allgemeine Chemie. Band 264, Nr. 2–4, März 1951, S. 144–150, doi:10.1002/zaac.19512640208.
- ↑ Anton M. Heyns, Carl W. F. T. Pistorius: Polymorphism, high-pressure phase diagram and vibrational spectra of KSbF6. In: Spectrochimica Acta Part A. Band 32, Nr. 3, 1976, S. 535–545, doi:10.1016/0584-8539(76)80114-6.

