Ketone
| Ketone |
|---|

|
| R1 und R2 sind organische Reste (Alkyl, Aryl o. ä.). Die Carbonylgruppe ist blau markiert. |
Ketone sind chemische Verbindungen, die als funktionelle Gruppe eine nicht endständige Carbonylgruppe (>C=O) enthalten. Eine Ketongruppe [C–C(O)–C] enthält drei Kohlenstoffatome. Alle Ketone enthalten mindestens drei Kohlenstoffatome. Im Gegensatz zu den Aldehyden ist hier der Carbonylkohlenstoff in beide Bindungsrichtungen mit Kohlenstoffatomen verbunden. Ketone kann man als Oxidationsprodukte sekundärer Alkohole auffassen. Die von den Alkanen ableitbaren Ketone nennt man auch Alkanone. Entsprechend bezeichnet man die auf Alkene und Alkine zurückzuführenden Ketone als Alkenone (siehe Enone) bzw. Alkinone. Das einfachste Keton ist Aceton. Ein einfaches aromatisches Keton ist Benzophenon (Diphenylketon). Ein gemischtes Keton ist Acetophenon (Methylphenylketon). Physiologisch entstehen bestimmte Ketone als Stoffwechselprodukt in der Leber.
Nomenklatur
[Bearbeiten | Quelltext bearbeiten]Nach der IUPAC-Nomenklatur erhalten Ketone das Suffix -on, sofern die Carbonylgruppe die im Molekül enthaltene Gruppe mit höchster Priorität ist. Entsprechend heißt das vom Propan abgeleitete Keton Propan-2-on (CH3–CO–CH3, Trivialname: Aceton). Die Carbonylgruppe erhält die kleinstmögliche Nummer, diese steht regelkonform direkt vor der Endung -on, wird aber oft auch vor den Stammnamen gesetzt. Beispielsweise heißt CH3–CH2–CH2–CO–CH3 Pentan-2-on oder 2-Pentanon. Falls die Carbonylgruppe nicht die höchste Priorität besitzt, verwendet man das Präfix Oxo-. Zum Beispiel heißt CH3–CO–CHO 2-Oxopropanal.
Sehr häufig tragen die Ketone jedoch Namen, welche aus der Bezeichnung der Alkylreste gefolgt von der Endung -keton bestehen (Radikofunktionelle Nomenklatur). So wird Butan-2-on auch Methylethylketon (MEK) genannt. Falls der eine Substituent eine Phenylgruppe ist, ist die Endung -phenon gebräuchlich, wie zum Beispiel bei Acetophenon.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Niedermolekulare Ketone sind farblose, leichtbewegliche Flüssigkeiten und aufgrund der Polarität der Carbonylgruppe in Wasser löslich. Niedermolekulare Ketone zeichnen sich durch einen meist angenehmen, fruchtigen Geruch aus. Höhermolekulare Ketone sind feste Stoffe.
Ketone besitzen auf Grund des +I-Effekts der Alkylsubstituenten am Carbonyl-Kohlenstoffatom eine niedrigere Reaktionsfreudigkeit als Aldehyde und neigen nicht zur Polymerisation. Im Unterschied zu den Aldehyden erfolgt mit Ketonen keine Reaktion bei der Fehling-Probe, da die Ketongruppe unter Erhalt des Kohlenstoffgerüsts nicht weiter oxidiert werden kann.
Herstellung
[Bearbeiten | Quelltext bearbeiten]- Ketone lassen sich durch Oxidation von sekundären Alkoholen herstellen.
- Eine weitere Herstellungsmethode ist die Ozonolyse von Alkenen.
- Die wichtigste Herstellungsmethode für aromatische Ketone ist die Friedel-Crafts-Acylierung.
- Nach der Ketonsynthese von Gilman und van Ess erhält man aus einer Carbonsäure (R1+1) und einer Lithiumalkyl-Verbindung (R2) durch Hydrolyse das analoge Keton
- Eine weitere Herstellungsmethode ist die Umsetzung von Weinreb-Amiden mit Alkyl-Lithium-Verbindungen und anschließender wässrig-saurer Aufarbeitung.
- Eine mittlerweile historische Synthese stellt die sogenannte Kalksalzdestillation dar, bei der Calciumsalze von Carbonsäuren trocken erhitzt und das gasförmig freiwerdende Keton rekondensiert wird (beispielsweise zur Darstellung von Aceton aus Calciumacetat).
- Aceton fällt als Kuppelprodukt bei der industriellen Phenolsynthese nach dem Cumolhydroperoxid-Verfahren (Hock-Verfahren) an.
- Wasseraddition an Alkine.[1]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Ketone gehen, ähnlich wie Aldehyde, Additions- und Kondensationsreaktionen ein.
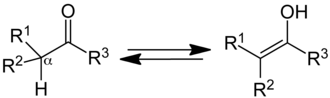
Ketone (R1, R2, R3 = Organyl-Rest) stehen mit ihrer tautomeren Form, den Enolen im Gleichgewicht (Keto-Enol-Tautomerie), wenn an das α-Kohlenstoffatom ein Wasserstoffatom gebunden ist:
Zum Schutz gegen unerwünschte Reaktionen werden Ketone mit Diolen zu Vollacetalen (siehe Schutzgruppe) umgesetzt:

Bei der Umsetzung des Vollacetals mit Wasser entsteht säurekatalysiert wieder das Keton, d. h. die Schutzgruppe wird abgespalten.
Ketone lassen sich im Gegensatz zu den Aldehyden nur unter drastischen Reaktionsbedingungen oxidativ angreifen. Dabei wird eine Bindung zwischen Carbonylkohlenstoff und einem Nachbarkohlenstoff gespalten. Die entstehenden Molekülbruchstücke sind Carbonsäuren.
Wichtige Vertreter der Ketone
[Bearbeiten | Quelltext bearbeiten]- Aceton, Cyclohexanon
- Himbeerketon, Mycosporin
- Butinon, der einfachste Vertreter der Ketone mit einer zusätzlichen C≡C-Dreifachbindung
Verwendung
[Bearbeiten | Quelltext bearbeiten]- Aceton: Lösungsmittel, Reinigungsmittel
- Cyclohexanon: Herstellung von Perlon
- Himbeerketon: Aromatisierung von Lebensmitteln (Geruch nach Himbeeren)
Spektroskopie von Ketonen
[Bearbeiten | Quelltext bearbeiten]In IR-Spektren von Ketonen und Aldehyden findet man die charakteristische Bande der C=O-Valenzschwingung im Bereich von 1690 bis 1750 cm−1.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- K. Peter C. Vollhardt, Neil E. Schore: Organische Chemie. 4. Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-31380-X.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Joachim Buddrus: Grundlagen der Organischen Chemie. 4. Auflage, Walter de Gruyter Verlag, Berlin 2011, ISBN 978-3-11-024894-4, S. 479.