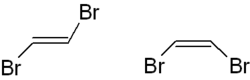Nomenklatur (Organische Chemie)
Die Nomenklatur in der Organischen Chemie umfasst sowohl die nicht systematischen und oft bei der Entdeckung eines Stoffes geprägten Trivialnamen als auch verschiedene Vorgehensweisen zur Generierung systematischer Namen für organische Verbindungen. Das Ziel eines Namens soll sein, die Struktur und, wo anwendbar, die Konfiguration und Konformation einer organischen Verbindung eindeutig zu beschreiben. Umgekehrt gibt es für eine gegebene Strukturformel oft mehrere Namen oder Möglichkeiten, systematische Namen festzulegen.
Die wichtigsten und umfassendsten Regeln zur systematischen Benennung organischer Verbindungen wurden von der International Union of Pure and Applied Chemistry (IUPAC) erarbeitet. Die Empfehlungen der IUPAC werden im sogenannten Blue Book publiziert.[1] Der größte Teil des Artikels befasst sich damit und verzichtet darauf, Namensbestandteile zu nennen, von deren Verwendung die IUPAC abrät.
Arten der Nomenklatur
[Bearbeiten | Quelltext bearbeiten]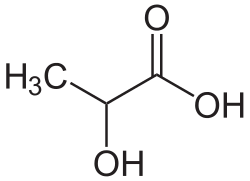
Die größte Bedeutung innerhalb der Systematik besitzt die substitutive Nomenklatur:[2] Man geht dabei von einem Stammsystem als atomares Grundgerüst aus, das durch die Ersetzung von Wasserstoffatomen (Substituenten, Mehrfachbindungen, Ladungen, Radikale) verändert wird. Ein Substituent ist dabei ein Atom, eine Seitenkette oder eine funktionelle Gruppe, welche ein Wasserstoffatom des Stammsystems ersetzt (substituiert). Für die Benennung der Verbindung wird der Name des Stammsystems direkt übernommen oder ggf. angepasst, und die Namen der substituierenden Gruppen werden dem Stammsystem als Präfixe oder als Suffix angefügt. Die ranghöchste funktionelle Gruppe oder ein Radikal oder Ion bestimmt das Suffix, alle anderen Substituenten werden als Präfix vorangestellt.[3] In der Regel dienen Lokanten der genauen Beschreibung der Positionen der Substituenten, meist als Nummern der C-Atome im Stammsystem. Als Ergänzung zum Stammsystem werden bei entsprechenden Verbindungen Deskriptoren genannte Präfixe vor dem systematischen Substanznamen ergänzt [z. B. cis-, trans-, (E)-, (Z)-, tert-, D-, L-, meso-, (±)-, (+)-, (−)-, (RS)-, (R)-, (S)-], die unter anderem die Konfiguration oder die Konformation des Moleküls beschreiben. Häufig werden Deskriptoren in Kombination mit Lokanten verwendet, um eine chemische Struktur eindeutig zu benennen.
Neben der substitutiven Nomenklatur wird die früher sehr gebräuchliche radikofunktionelle Nomenklatur auf ein absolutes Minimum beschränkt.[4] In dieser Nomenklatur bestimmt die Zugehörigkeit zu einer funktionellen Gruppe die Endung des Namens. Dieser Endung wird ein Substituent als Radikal vorangestellt. Beispielsweise lautet der radikofunktionelle Name für Methanol Methylalkohol. Radikofunktionelle Namen werden bevorzugt für Carbonsäureester, Carbonsäurehalogenide und Pseudohalogene verwendet.
Die multiplikative Nomenklatur findet Verwendung, wenn mehrere identische Stammsysteme in der Verbindung vorkommen.[5] So erhält z. B. die Verbindung Triphenylmethan nach multiplikativer Nomenklatur den Namen 1,1',1''-Methantriyltribenzol.
Die Ersetzungsnomenklatur, auch „a“-Nomenklatur oder Austauschnomenklatur, wird hauptsächlich angewendet, wenn ein Heteroatom in einem zyklischen Stammsystem auftritt (Heterocyclus) oder wenn dadurch ein einfacherer Name für ein acyclisches Stammsystem erhalten wird.[6] Der Kronenether 18-Krone-6 erhält damit den Namen 1,4,7,10,13,16-Hexaoxacyclooctadecan.
Die funktionelle Ersetzungsnomenklatur wird manchmal verwendet, wenn Sauerstoffatome in funktionellen Gruppen oder Stammsystemen durch Halogene, Chalkogene oder Stickstoffatome ersetzt werden.[7] Dazu zählt beispielsweise die systematische Benennung der Peroxyessigsäure als Ethanperoxosäure.
Die konjunktive Nomenklatur kann als Alternative zur substitutiven Nomenklatur eingesetzt werden, wenn cyclische Substituenten an ein acyclisches Stammsystem gebunden sind, wobei letzteres die ranghöchste Gruppe trägt.[8] Die IUPAC rät von der Verwendung dieser Nomenklatur ab, sie wird jedoch in den Datenbanken des Chemical Abstracts Service verwendet. Die (1H-Indol-3-yl)essigsäure heißt mit konjunktiver Nomenklatur 1H-Indol-3-essigsäure.
Operationen
[Bearbeiten | Quelltext bearbeiten]Zur Generierung eines Namens sind eine Reihe von Operationen nötig, die alle auf ein Stammsystem angewendet werden. Die Operation verändert den Namen des Stammsystems z. B. durch Präfixe, Infixe oder Suffixe.[9]
- Substitutive Operation: Austausch eines Wasserstoffatoms des Stammsystems gegen ein anderes Atom oder eine Atomgruppe.
- Ersetzungsoperation: Austausch einer Atomgruppe oder eines Nicht-Wasserstoffatoms durch ein anderes Atom.
- Additive Operation: Zusammenfügen einer Struktur aus Bestandteilen ohne Verlust von Atomen.
- Subtraktive Operation: Entfernen eines oder mehrerer Atome aus dem Stammsystem.
- Konjunktive Operation: Zusammenfügen einer Struktur aus Stammsystemen mit Verlust der gleichen Anzahl Wasserstoffatome aus jedem Bestandteil.
- Multiplikative Operation: Verbinden mehrerer identischer Stammsystemen durch eine symmetrische mehrbindige Struktur.
- Fusionsoperation: Vereinigung von Ringen, z. B. in Spiroverbindungen.
Stammsysteme
[Bearbeiten | Quelltext bearbeiten]Mit Ausnahme des ersten Abschnitts beziehen sich alle folgenden Ausführungen auf Kohlenstoff-haltige Stammsysteme. Es gibt zahlreiche Verbindungen, welche keine Kohlenstoff-basierte Stammsysteme haben, z. B. Diphenyldiazen (Trivialname Azobenzol) mit den zwei durch eine Doppelbindung verknüpften N-Atomen (Stammsystem Diazan).
Auswahl eines Stammsystems
[Bearbeiten | Quelltext bearbeiten]Als Stammsystem kann ein Stammhydrid ohne oder mit funktioneller Gruppe (z. B. Cyclohexan oder Cyclohexanol) oder eine Stammverbindung (z. B. Essigsäure) verwendet werden. Die Auswahl des (cyclischen oder acyclischen) Stammsystems erfolgt in dieser (nicht abschließenden und vollständigen) Reihenfolge:[10]
- Das Stammsystem muss die maximale Anzahl der Substituenten enthalten, die als ranghöchste funktionelle Gruppe ausgewählt wurden.
- Das Stammsystem muss die maximale Anzahl Atome der Elemente N > P > … > C enthalten.
- Sind die gleichen Stoffklassen vorhanden, wird ein Ring vor einer Kette bevorzugt.
und so weiter.
Die Regel, wonach die Stammkette eines Kohlenwasserstoffs die meisten Mehrfachbindungen aufweisen soll, ist veraltet. Sie wurde der Forderung nach der maximalen Anzahl Atome in der Kette untergeordnet.[10]
Stammhydride enthalten eine definierte Population Wasserstoffatome an einem Grundgerüst. Sie sind entweder gesättigte Ketten oder Ringe bzw. ungesättigte Ringe, welche die maximale Anzahl nichtkumulierter Doppelbindungen aufweisen (englisch "mancude" = maximal number of non cumulated double bonds).
Ein einfaches systematisches Stammhydrid mit Kohlenstoff-Atomen ist Pentan. An die fünf C-Atome sind 12 H-Atome gebunden, welche substituiert werden können:
Einatomige und acyclische Kohlenwasserstoffe
[Bearbeiten | Quelltext bearbeiten]Die einfachsten Stammhydride sind einzelne Atome oder Ketten aus identischen Atomen, bei denen alle Bindungen mit Wasserstoffatomen gesättigt sind. Solche gesättigte Kohlenwasserstoffe nennt man Alkane, sie erhalten die Endung -an. Für die vier kleinsten Alkane werden die Namen Methan, Ethan, Propan und Butan beibehalten, für die übrigen Alkane ergibt sich der genaue Name des Stammsystems nach der folgenden Tabelle aus der Anzahl der Kohlenstoffatome. Man kombiniert das Zahlwort der ersten Dekade mit den Zahlwörtern für die folgenden Dekaden. Am Ende folgt ein n, sodass man die Alkan-typische Endung -an erhält.[11]
| 1 | Hen | 10 | Deca | 100 | Hecta | 1000 | Kilia | |||
| 2 | Do | 20 | Cosa | 200 | Dicta | 2000 | Dilia | |||
| 3 | Tri | 30 | Triaconta | 300 | Tricta | 3000 | Trilia | |||
| 4 | Tetra | 40 | Tetraconta | 400 | Tetracta | 4000 | Tetralia | |||
| 5 | Penta | 50 | Pentaconta | 500 | Pentacta | 5000 | Pentalia | |||
| 6 | Hexa | 60 | Hexaconta | 600 | Hexacta | 6000 | Hexalia | |||
| 7 | Hepta | 70 | Heptaconta | 700 | Heptacta | 7000 | Heptalia | |||
| 8 | Octa | 80 | Octaconta | 800 | Octacta | 8000 | Octalia | |||
| 9 | Nona | 90 | Nonaconta | 900 | Nonacta | 9000 | Nonalia |
Beispiele:
- C32H66 = Dotriacontan (Do + Triaconta + n)
- C99H200 = Nonanonacontan (Nona + Nonaconta + n)
- C403H808 = Tritetractan (Tri + Tetracta + n)
- C4728H9458 = Octacosaheptactatetralian (Octa + Cosa + Heptacta + Tetralia + n)
- C9999H20000 = Nonanonacontanonactanonalian (Nona + Nonaconta + Nonacta + nonalia + n)
Ausnahmen von der Benennung nach der obigen Tabelle gibt es bei:
| Anzahl der C-Atome | Verbindung | Name |
|---|---|---|
| 1 | CH4 | Methan |
| 2 | C2H6 | Ethan |
| 3 | C3H8 | Propan |
| 4 | C4H10 | Butan |
| 11 | C11H24 | Undecan |
| 20 | C20H42 | Icosan |
| 21 | C21H44 | Henicosan |
Monocyclische Stammsysteme
[Bearbeiten | Quelltext bearbeiten]Kohlenwasserstoffe
[Bearbeiten | Quelltext bearbeiten]Falls es sich um eine gesättigte monocyclische Verbindung handelt, erfolgt die Benennung wie bei linearen Ketten, und zusätzlich wird die Vorsilbe Cyclo- vorangestellt, also z. B. Cyclohexan. Monocyclische Verbindungen mit mehr als sechs C-Atomen, die die maximale Anzahl nicht kumulierter Doppelbindungen aufweisen, können als [n]Annulene bezeichnet werden (n = Anzahl der C-Atome).[11] Für Benzol wird der Trivialname beibehalten.
Heteromonocyclen
[Bearbeiten | Quelltext bearbeiten]Eine Reihe von Trivialnamen werden beibehalten, z. B. Furan, Pyridin oder Oxazol. Monocyclische Heterocyclen mit bis zu zehn Ringgliedern benennt man nach dem Hantzsch-Widman-System. Diese Namen setzen sich aus zwei Teilen zusammen, einem oder mehrerer Präfixe zur Kennzeichnung des oder der Heteroatome und einer Endung, die sich auf Ringgröße und Sättigung bezieht. Die Art und Position der Heteroatome wird mit Hilfe der Ersetzungsnomenklatur („a“-Nomenklatur) angegeben. So erhält z. B. die meist Tetrahydrofuran genannte Verbindung den systematischen Namen Oxolan: Oxa für das Sauerstoffatom, wobei das a weggelassen wird, und olan für einen fünfgliedrigen, gesättigten Ring.[12]
Anellierte polycyclische Stammsysteme
[Bearbeiten | Quelltext bearbeiten]Anelliert bedeutet, dass zwei Ringe eine gemeinsame Bindung besitzen, woran zwei Atome direkt gebunden sind.[13] Auf diese Weise können auch mehr als zwei Ringe miteinander anelliert werden.
Kohlenwasserstoffe
[Bearbeiten | Quelltext bearbeiten]Für 63 polycyclische Kohlenwasserstoffe werden beibehaltene Namen (Trivialnamen) verwendet. Hier folgt eine Auswahl in absteigender Rangfolge und mit der Anzahl Ringe in Klammern angegeben:[13][14][11]
Ovalen (10), Pyranthren (8), Coronen (7), Rubicen (7), Perylen (5), Picen (5), Pleiaden (4), Chrysen (4), Pyren (4), Fluoranthen (4), Anthracen (3), Phenanthren (3), Phenalen (3), Fluoren (3), s-Indacen (3), Azulen (2), Naphthalin (2), Inden (2).
Alle übrigen Ringe werden als Vorsilben vorangestellt, wobei die Endsilbe -en in -eno umgewandelt wird (z. B. Indeno(2,3-cd)pyren). Ausnahmen sind Anthro- (für Anthracen), Benzo- (für Benzol), Naphtho- (für Naphthalin) und Phenanthro- (für Phenanthren). Die Art der Verknüpfung wird durch Zahlen und Buchstaben angegeben, was aber hier nicht näher erläutert werden soll.[13][15]
Weitere polycyclische Kohlenwasserstoffe folgen einer systematischen Nomenklatur, z. B. die Polyacene, Polyphenylene oder Polyhelicene.[13][15]
Heterocyclen
[Bearbeiten | Quelltext bearbeiten]Auch für kondensierte Heterocyclen gibt es Systeme mit beibehaltenen Trivialnamen, z. B. Xanthen, Phenanthrolin oder Purin. Die systematische Benennung kondensierter Heterocyclen erfolgt ähnlich wie für die Kohlenwasserstoffe, indem dem Hauptring die Namen der weiteren Monocyclen angefügt werden.[13][15]
Verbrückte polycyclische Stammsysteme
[Bearbeiten | Quelltext bearbeiten]
Bei verbrückten Kohlenwasserstoffen verbindet eine Bindung oder eine unverzweigte Kette zwei unterschiedliche Atome eines Moleküls. Zur Benennung solcher Verbindungen wird das Von-Baeyer-System verwendet. Im Hauptring mit der größtmöglichen Atomzahl werden Atome als Brückenköpfe ermittelt und die gebildeten Brücken als Zahlenfolge in eckigen Klammern, dem so genannten Von-Baeyer-Deskriptor, angegeben. Als einfaches Beispiel dient das Norbornan, welches systematisch als Bicyclo[2.2.1]heptan benannt wird.[16][17] Cyclophane können nach den gleichen Regeln benannt werden, obwohl es für diese auch eine eigene Nomenklatur gibt.[18]
Spiroverbindungen
[Bearbeiten | Quelltext bearbeiten]
In Spiroverbindungen sind zwei Ringe über ein einziges gemeinsames Atom, das sogenannte Spiro-Atom, verbunden. Die Spiro-Nomenklatur folgt dem Von-Baeyer-System: Die Atomzahlen beider Ringe werden ohne das Spiro-Atom aufsteigend in eckige Klammern gesetzt. Diesem Von-Baeyer-Deskriptor wird das Präfix spiro vorangestellt, nach dem Deskriptor folgt der Stammname. Das Beispiel 1,6-Dioxaspiro[4.4]nonan-2,7-dion enthält als Stammsystem spiro[4.4]nonan. Zwei der neun Atome des Stammsystems sind durch Ersetzungsnomenklatur als Sauerstoffatome angegeben. Die neun Atome sind am Spiro-Atom symmetrisch verknüpft.[19][20]
Charakteristische bzw. funktionelle Gruppen und Substituenten
[Bearbeiten | Quelltext bearbeiten]Verändern der Anzahl Wasserstoffatome im Stammsystem
[Bearbeiten | Quelltext bearbeiten]Das Stammsystem besitzt eine definierte Population von Wasserstoffatomen. Durch additive oder subtraktive Operationen können vom Stammsystem abweichende Wasserstoffpopulationen in einer Verbindung benannt werden. Die IUPAC zählt auch ungesättigte Kohlenstoff-Kohlenstoff-Bindungen in acyclischen und alicyclischen Verbindungen zu den funktionellen Gruppen.[21][22]
Doppel- und Dreifachbindungen in ansonsten gesättigten Systemen
[Bearbeiten | Quelltext bearbeiten]Durch Entfernen von Wasserstoffatomen (subtraktive Operation) benennt man Verbindungen mit Mehrfachbindungen. Bei den Kohlenwasserstoffen spricht man im Falle einer Doppelbindung von Alkenen und verwendet statt der Endung -an die Endung -en. Bei Kohlenwasserstoffen mit einer Dreifachbindung, den so genannten Alkinen, wird die Endung -in verwendet. Die Position der Mehrfachbindung wird durch eine Ziffer als Lokant angegeben (s. a. unten bei Lokanten).[22]
Beispiele:
- CH2=CH–CH2–CH3 heißt But-1-en (früher 1-Buten).
- CH3–CH=CH–CH3 heißt But-2-en.
- CH≡C–CH2–CH3 heißt But-1-in (früher 1-Butin).
- CH2=CH–CH2–C≡C–CH2–CH3 heißt Hept-1-en-4-in.
Falls mehrere Doppel- oder Dreifachbindungen vorkommen, verwendet man die multiplizierenden Vorsilben di, tri, tetra, penta, hexa, hepta und so weiter, wobei vor den Lokanten der Buchstabe a eingeschoben wird:
- CH2=CH–CH=CH2 heißt Buta-1,3-dien.
- CH≡C–C≡C–C≡C–CH3 heißt Hepta-1,3,5-triin.
Hinzufügen oder Entfernen von Wasserstoffatomen bei Ringsystemen
[Bearbeiten | Quelltext bearbeiten]Zur Benennung von gesättigten oder teilweise gesättigten Derivaten cyclischer Verbindungen mit der maximalen Anzahl konjugierter Doppelbindungen gibt es die Möglichkeit, beim Wegfallen einer Doppelbindung die beiden zusätzlichen Wasserstoffatome durch die Positionsnummern und die Vorsilbe dihydro- unmittelbar vor dem Namen des Stammhydrids anzuzeigen z. B. 1,2-Dihydropyridin. Analog gibt es tetrahydro-, hexahydro- und so weiter. Einzelne zusätzliche Wasserstoffatome werden durch das sogenannte indizierte H angegeben, welches in kursiver Schrift vorangestellt wird (z. B. 4H-Pyrazol).[23]
Mit der Vorsilbe dehydro- kann das Entfernen von Wasserstoffatomen angezeigt werden, z. B. in 1,2-Didehydrobenzol.[24]
Substituenten
[Bearbeiten | Quelltext bearbeiten]Ein Substituent kann z. B. eine funktionelle Gruppe sein, oder wiederum ein Stammsystem mit geringerer Priorität, etwa eine Seitenkette. Die Bezeichnungen für Substituenten werden dem Namen des Stammsystems als Vorsilben (Präfixe) oder Endungen (Suffixe) angefügt. Die genaue Position des Substituenten wird durch Lokanten präzisiert (siehe auch unten).
Falls es mehrere Substituenten als Präfixe gibt, werden diese in alphabetischer Reihenfolge aufgelistet, multiplizierende Vorsilben ändern die Reihenfolge nicht, z. B. Dibrom- vor Chlor-. Es gilt dabei immer der erste Buchstabe des Substituenten, z. B. Dimethylamino.[25]
Stammsysteme als Substituenten
[Bearbeiten | Quelltext bearbeiten]Falls es sich beim Rest wiederum um ein Stammsystem handelt, zum Beispiel eine Seitenkette oder einen Ring, so wird an dessen Namen die Silbe -yl für einfach gebundene, -yliden für doppelt gebundene oder (selten) -ylidin für dreifach gebundene Substituenten angehängt und der so erhaltene Namensteil als Vorsilbe (Präfix) dem Stammnamen vorangestellt. Die Benennung folgt zwei Methoden:[26][27]
- Die Silben -yl, -yliden und -ylidin ersetzen die Endung -an des Stammhydrids. Das an das Stammsystem gebundene Atom befindet sich am Kettenanfang und erhält den Lokanten 1, dieser wird im Namen jedoch weggelassen. Diese Methode findet vorwiegend für gesättigte acyclische und cyclische Substituenten Verwendung.
- Die Silben -yl, -yliden und -ylidin werden dem Namen des Stammhydrids angefügt. Wenn sich das ans Stammsystem gebundene Atom nicht am Kettenanfang befindet, erhält als Lokant die tiefstmögliche Nummer.
Beispiele:
- Methyl: –CH3
- Methyliden: =CH2
- Ethinyl: –C≡CH
- Propan-2-yl: –CH(CH3)2
- Prop-2-enyl (Allyl): –CH2–CH=CH2
- Cyclohexyl: –C6H11
Wenn man beispielsweise an die Verbindung Propan (CH3–CH2–CH3) in der Mitte noch einen Methanbaustein anhängt, heißt die entstehende Verbindung CH3–CH(CH3)–CH3 dann 2-Methylpropan. Die Verbindung CH3–CH2–CH(CH3)–CH2–CH(CH2CH3)–CH2–CH3 heißt 3-Ethyl-5-methylheptan.
Die Namen der Element-Wasserstoff-Gruppen werden analog aus der Stammverbindung gebildet:
- Germyl: -GeH3
- Silyl: -SiH3
- Trimethylsilyl: -Si(CH3)3
Für einige Substituenten gibt es Trivialnamen, welche beibehalten wurden und weiter substituiert werden dürfen, wie z. B. Phenyl (–C6H5) oder Benzyl (–CH2–C6H5). Andere Trivialnamen sind zwar erlaubt, jedoch nur in der allgemeinen Nomenklatur und nicht für bevorzugte IUPAC-Namen, z. B. Isopropyl (–CH–(CH3)2), Vinyl (–CH=CH2) oder Allyl (–CH2–CH=CH2). Sie dürfen im Allgemeinen nicht weiter substituiert werden.[26]
Funktionelle Gruppen
[Bearbeiten | Quelltext bearbeiten]Die ranghöchste funktionelle Gruppe wird als Endung (Suffix) hinten angestellt, übrige funktionelle Gruppen als Vorsilben (Präfixe) vorangestellt:[3][28]
- CH3–CH(OH)–CH3 heißt Propan-2-ol
- CH3–CH2–CH2–C(OOH) heißt Butansäure
- CH3–CH(OH)–C(OOH) hat zwei funktionelle Gruppen. Die Carbonsäure hat Vorrang, deshalb heißt die Verbindung 2-Hydroxybutansäure (Trivialname: Milchsäure).
Für die Bezeichnungen einzelner funktioneller Gruppen und ihre Rangfolge siehe das Stichwort Funktionelle Gruppe.

Regeln für die Zusammensetzung der Namen
[Bearbeiten | Quelltext bearbeiten]Rangfolge der funktionellen Gruppen und Substituenten
[Bearbeiten | Quelltext bearbeiten]Die im Molekül enthaltene Teilstruktur mit der höheren Rangfolge legt das Suffix des Namens fest:
- Radikale
- Radikalanionen
- Radikalkationen
- Anionen
- Kationen
- Zwitterionen
- Säuren
- Anhydride
- Ester
- Säurehalogenide
und so weiter.
Eine umfassendere Auflistung findet sich bei den funktionellen Gruppen.
Lokanten
[Bearbeiten | Quelltext bearbeiten]Lokanten dienen zur genauen Beschreibung der Position von Atomen.[29] Am häufigsten werden arabische Zahlen verwendet. Zusätzlich werden unter Umständen Hochkommas hinzugefügt, um zwischen demselben Lokanten in denselben oder verschiedenen Teilen der Struktur zu unterscheiden, zum Beispiel 1′, 2′′, N′, und α′. Die Nummerierung des Stammsystems und deren Reihenfolge folgt dabei einer Reihe von Regeln.[30] Die am häufigsten angewendeten Regeln sind:
- Das Atom mit der prioritären Gruppe erhält die tiefstmögliche Nummer. So heißt es Cyclohex-2-en-1-amin statt Cyclohex-1-en-3-amin.
- Mehrfachbindungen erhalten die tiefstmöglichen Nummern. Statt 2-Methylpent-3-en muss es 4-Methylpent-1-en heißen.
- Die erhaltenen Nummern sind möglichst klein. CH3–CH2–CH2–CH(CH3)–CH3 heißt also 2-Methylpentan und nicht 4-Methylpentan. Dabei gilt, wie im Fall der Bestimmung der Hauptkette, dass nicht die Summe der Positionsnummern möglichst klein sein muss, sondern dass die erste unterscheidbare Stelle den kleinsten Wert annimmt, siehe Bild. Dies gilt auch, wenn Positionsnummern mehrfach vorkommen wie zum Beispiel bei ClCH2–CF3 (2-Chlor-1,1,1-trifluorethan statt 1-Chlor-2,2,2-trifluorethan).
und so weiter.
Die Lokanten müssen unmittelbar vor dem Namensteil stehen, auf den sie sich beziehen, es heißt also regelkonform Propan-2-ol und nicht 2-Propanol. Der Lokant (meistens die Nummer 1) kann nur in bestimmten Fällen weggelassen werden:[29]
- Bei Mono- und Dicarbonsäuren, wenn sie an acyclische Stammsysteme gebunden sind, und bei deren entsprechenden Carbonsäurehalogeniden, Amiden, Hydraziden, Nitrilen, Estern, Aldehyden und so weiter. Diesen funktionellen Gruppen ist gemeinsam, dass sie am Anfang eines acyclischen Stammsystems gebunden sein müssen.
- An einatomigen Stammsystemen, z.B. Trichlormethan statt 1,1,1-Trichlormethan
- An monosubstituierten homogenen Ketten aus zwei identischen Atomen, z. B. Ethanol statt Ethan-1-ol.
- An monosubstituierten homogenen monocyclischen Ringen, z. B. Cyclohexanol statt Cyclohexan-1-ol.
- Wenn alle substituierbaren Atome gleich substituiert sind, z. B. Hexachlorbenzol statt 1,2,3,4,5,6-Hexachlorbenzol.
- und so weiter.
Bei kondensierten polycyclischen Systemen existieren ggf. verbindliche Nummerierungsschemata, die jeweils nachgeschlagen werden müssen (siehe z. B. Naphthalin).[30]
Multiplikative Präfixe
[Bearbeiten | Quelltext bearbeiten]Für mehrfach vorkommende Eigenschaften (Substituenten, charakteristische Gruppen, Mehrfachbindungen) werden die multiplizierenden Vorsilben di, tri, tetra, penta, hexa, hepta, … verwendet:[31]
- ein Benzolring mit drei Methylgruppen an den Positionen 1, 3 und 5 heißt 1,3,5-Trimethylbenzol,
- Methan mit vier Chloratomen heißt Tetrachlormethan,
- Oxalsäure mit zwei Carbonsäuregruppen heißt Ethandisäure,
- Isopren heißt 2-Methylbuta-1,3-dien etc.
Falls die Verwendung von di, tri, tetra usw. missverständlich wäre, etwa bei identischen weitersubstituierten Seitenketten, muss man die entsprechenden alternativen Vorsilben bis, tris, tetrakis usw. verwenden. Für direkt verknüpfte identische Einheiten sind die Vorsilben bis, ter, quater usw. in Verwendung.
Interpunktion
[Bearbeiten | Quelltext bearbeiten]Kommas
[Bearbeiten | Quelltext bearbeiten]Kommas trennen Lokanten, die zum selben Teil eines Namens gehören (d. h. Lokanten einer Reihe), sowie Buchstaben oder Buchstabenkombinationen, die die Anellierungsstellen anellierter Ringsysteme bezeichnen.[32]
Beispiele:
- 1,2-Dichlorethan
- Dibenzo[a,j]anthracen
- N,N-Diethyl-2-furamid
Punkte
[Bearbeiten | Quelltext bearbeiten]Punkte trennen numerische Indikatoren der Ringgröße in Namen, die nach dem von-Baeyer-System gebildet wurden. Sie werden zudem in einigen Spiro-Namen verwendet.[32]
Beispiele:
Doppelpunkte und Semikolons
[Bearbeiten | Quelltext bearbeiten]Doppelpunkte trennen zusammenhängende Sätze von Lokanten. Falls eine stärkere Trennung erforderlich ist, werden Semikolons verwendet.[33]
Beispiele:
- 1,2:5,6-Di-O-isopropyliden-α-D-glucofuranose
- 1,2:3,4-Diepoxybutan
- Benzo[1′′,2′′:3,4;4′′,5′′:3′,4′]dicyclobuta[1,2-b:1′,2′-c′]difuran[34]
Leerzeichen und Bindestriche
[Bearbeiten | Quelltext bearbeiten]An allen Stellen, wo im Englischen Leerzeichen zwischen den Worten eines Namens verwendet werden, stehen im Deutschen Bindestriche[35] oder das Leerzeichen entfällt. Die Verwendung von Bindestrichen ist dabei zuweilen etwas willkürlich. Wenn es der Klarheit dient, sollte man hier etwas großzügig sein.[36]
Bindestriche werden in FORMELN und in NAMEN verwendet:[37]
- Um Lokanten von Worten oder Morphemen des Namens zu trennen. Beispiel: But-2-en
- Um einen Stereodeskriptor von einem Namen zu trennen. Beispiel: (E)-But-2-en
- Um Symbole wie µ vom Rest der Formel oder des Namens zu trennen.
- Um Strukturdeskriptoren wie cyclo, catena, triangulo, quadro, tetrahedro, octahedro, closo, nido, arachno, cis und trans sowie z. B. Λ und α vom Rest der Formel oder des Namens zu trennen. In den Bezeichnungen von Aggregaten oder Clustern werden Lokanten in gleicher Weise getrennt.
- Um das Symbol des markierenden Nuklids von seinem Lokanten in der Formel einer selektiv-markierten Verbindung zu trennen.
- Um zu verschiedenen Namensteilen gehörende, zusammenstehende Lokanten zu trennen. Klammern sollten jedoch bevorzugt werden.
- Um den Namen eines Brückenliganden vom Rest des Namens zu trennen.
Nach Klammern erscheint ein Bindestrich nur dann, wenn der schließenden Klammer ein Lokant folgt, z. B. 3-(Bromcarbonyl)-4-(chlorcarbonyl)-2-methyl-benzoesäure. Zahlwörter (z. B. Tetra) werden ohne Bindestrich mit den Namen verknüpft.[38]
Klammern
[Bearbeiten | Quelltext bearbeiten]Um eindeutige Namen zu erhalten, werden in der Nomenklatur Namensteile und spezielle Angaben in Klammern gesetzt. Drei Arten von Klammern werden verwendet: runde ( ), eckige [ ] und geschweifte { }.[39][40] Die Verwendung von eckigen Klammern ist in der Anorganischen und Organischen Chemie allerdings unterschiedlich. Die folgenden Angaben beziehen sich ausschließlich auf die Organische Chemie.
Im Namen organischer Verbindungen werden von innen nach außen runde, eckige und geschweifte Klammern gesetzt: {[( )]}, {[({[( )]})]} usw. In Formeln wird die abweichende Reihenfolge [], [( )], [{( )}], [({( )})], [{({( )})}] verwendet.[39]
In runde Klammern werden unter anderem gesetzt:
- Substituenten, die selbst wieder substituiert sind, z.B. (Chlormethyl)silan statt Chlor(methyl)silan.
- Mehrfach vorkommende Einheiten, z. B. 1,1,1-Trimethyl-N,N-bis(trimethylsilyl)silanamin.
- Um Substituenten, die denselben Typ Lokant verwenden, z.B. 1-Methyl-4-(propan-2-yl)cyclohex-1-en (Limonen).
- Bei Oligosacchariden mit freier Halbacetal-Gruppe werden die Verknüpfungslokanten in runden Klammern zwischen die einzelnen Komponentennamen gesetzt, zum Beispiel β-D-Galactopyranosyl-(1→4)-α-D-glucopyranose.[40]
- Bei unvollständig isotop substituierten Verbindungen werden die Positionsziffern und Nuklidsymbole in runde Klammern gesetzt, zum Beispiel bei Dichlor(2H2)methan. Bei spezifischen, unselektiven, selektiv markierten, isotop defizitären oder angereicherten Verbindungen werden die Nuklidsymbole mit Multiplikationssubskripten in eckige Klammern gesetzt, zum Beispiel bei [13C,2H2]Methan, [def13C]Chloroform, [12C]Chloroform.[40]
In eckige Klammern werden unter anderem gesetzt:
- Bei polycyclischen Kohlenwasserstoffen werden die Verschmelzungspositionen von Teilstrukturen in eckigen Klammern dazwischengeschoben, zum Beispiel bei Benzo[a]anthracen.[40]
- Bei verbrückten polycyclischen Kohlenwasserstoffen im Von-Baeyer-System wird nach dem Begriff cyclo die Anzahl der C-Atome der beiden Zweige des Hauptringes, der Hauptbrücke und eventuell vorhandener Sekundärbrücken in absteigender Reihenfolge in eckigen Klammern angegeben, zum Beispiel Bicyclo[4.4.0]decan. Bei ungesättigten Brücken werden die Lokanten der Mehrfachbindungen in eckigen Klammern innerhalb des Brückenterms angegeben.[40]
- Bei Spiro-Kohlenwasserstoffen folgen dem Term Spiro die Summen der an das Spiroatom gebundenen C-Atome in eckigen Klammern, zum Beispiel Spiro[2.4]heptan. Muss man, um überhaupt eine Spiroverknüpfung realisieren zu können, erst eine formale (Di)-Hydrierung durchführen, wird der zusätzliche indizierte Wasserstoff direkt hinter der die Spiroverknüpfung betreffenden Ziffer in runde Klammern gesetzt.[40]
Konfiguration und Konformation
[Bearbeiten | Quelltext bearbeiten]Stereoisomere
[Bearbeiten | Quelltext bearbeiten]
Tetraedrische Stereozentren
[Bearbeiten | Quelltext bearbeiten]Zur Angabe der Konfiguration an tetraedrischen Stereozentren wird dem Namen ein kursiv geschriebenes R oder S als Stereodeskriptor in runden Klammern vorangestellt. Die Verwendung der Stereodeskriptoren wird durch die Cahn-Ingold-Prelog-Regel (CIP-Regel) und ihre Nebenregeln festgelegt. Wenn eine chirale Verbindung als 1:1-Gemisch der Enantiomere vorliegt – also ein Racemat ist – wird die Bezeichnung rac vorangestellt. Für allgemeine IUPAC-Namen verwendet man auch RS oder SR. Ist die Konfiguration R oder S unsicher oder unbekannt, kennzeichnet man dies durch ein ξ bzw. Ξ (griechischer Buchstabe Xi).[41]
Bei biochemischen Substanzen wie Kohlenhydraten und Aminosäuren wird auch noch häufig die Fischer-Nomenklatur verwendet, welche die Vorsilben D- und L- verwendet (wobei D und L als Kapitälchen geschrieben werden).
Zur Unterscheidung des Drehsinns bei optisch aktiven Verbindungen verwendet man das Symbol (+) oder (−).
Es sei darauf hingewiesen, dass sich die unterschiedlichen Stereodeskriptoren (R, S bzw. D, L und +, −) nicht von den jeweils anderen Bezeichnungen ableiten lassen. Zur systematischen Bezeichnung von Verbindungen mit mehreren Chiralitätszentren eignen sich nur die CIP-Regeln, wobei die Fischer-Nomenklatur beispielsweise für Zucker wesentlich kompakter ist.

Konfiguration an Doppelbindungen
[Bearbeiten | Quelltext bearbeiten]Die Konfiguration an Doppelbindungen wird mit dem Stereodeskriptor E (entgegen) oder Z (zusammen) gekennzeichnet. Dem Buchstaben wird direkt ein Lokant vorangestellt, Klammern umfassen den vollständigen Stereodeskriptor. Für Doppelbindungen mit je einem Wasserstoffatom an beiden Kohlenstoff-Atomen darf auch der Deskriptor cis oder trans verwendet werden. Dieser steht nicht in Klammern.
Bei einem (Z)-Isomer stehen jene zwei Substituenten an benachbarten Atomen einer Doppelbindung auf derselben Seite des Moleküls, die die höchste Priorität im Cahn-Ingold-Prelog-System haben, beim (E)-Isomer stehen die Substituenten mit der höchsten CIP-Priorität auf entgegengesetzten Seiten des Moleküls.[41]
Links ist das trans-1,2-Dibromethen, rechts die cis-Version dargestellt. Mit der (E,Z)-Nomenklatur wird
- trans-1,2-Dibromethen als (E)-1,2-Dibromethen,
- cis-1,2-Dibromethen als (Z)-1,2-Dibromethen
bezeichnet.
Anomere
[Bearbeiten | Quelltext bearbeiten]Bei Kohlenhydraten unterscheidet man Anomere durch die kursiven Vorsilben α- bzw. β-.
Nomenklaturregeln für weitere Verbindungen
[Bearbeiten | Quelltext bearbeiten]Für Naturstoffe und deren Derivate existieren weitere Nomenklaturregeln, z. Bsp. die sn-Nomenklatur für Glycerin.[42]
Bezeichnungsstandards außerhalb der IUPAC-Vorschriften
[Bearbeiten | Quelltext bearbeiten]Für den praktischen Umgang mit chemischen Stoffen im Alltag gibt es Normen, Nummernsysteme und Stoffdatenbanken unterschiedlicher Ausrichtung:
- Die E-Nummern bezeichnen in der Europäischen Union zugelassene Lebensmittelzusatzstoffe.
- Für Kunststoffe gibt es durch eine ISO-Norm festgelegte Kurzzeichen. Sie werden in Recycling-Codes verwendet.
- Die Bezeichnung von Farbstoffen und Pigmenten erfolgt nach der Systematik des Colour Index (C.I. Generic Name).
- Die CAS-Nummern sind eindeutige Identifikatoren für chemische Stoffe und Gemische in Form von gruppierten Nummern. Stand April 2018 hat die CAS-Datenbank einen Bestand von rund 140 Millionen Einträgen.[43]
- Die international gültigen UN-Nummern werden für Gefahrgüter verwendet. Sie werden einzelnen Substanzen oder Gruppen gleicher Gefahr zugeordnet und sind in der Logistikkette und für Rettungskräfte von Bedeutung.
- Stoffe, die in der EU gehandelt werden, haben EG-Nummern. Diese sind eine wichtige Ordnungskategorie des Europäischen Chemikalienrechts (REACH-Verordnung).
Literatur
[Bearbeiten | Quelltext bearbeiten]- D. Hellwinkel: Die systematische Nomenklatur der organischen Chemie. Eine Gebrauchsanweisung. 5., korr., erw. erg. Auflage. Springer, Berlin 2005, ISBN 3-540-26411-6.
- Karl-Heinz Hellwich: Chemische Nomenklatur. GOVI-Verlag, Eschborn 2002, ISBN 3-7741-0815-3.
- Ursula Bünzli-Trepp: Nomenklatur der Organischen Chemie, Metallorganischen Chemie und Koordinationschemie. Logos Verlag, Berlin 2001, ISBN 3-89722-682-0.
- Philipp Fresenius, Klaus Görlitzer: Organisch-chemische Nomenklatur: Grundlagen·Regeln·Beispiele. 4. durchgesehene und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1998, ISBN 3-8047-1588-5.
- IUPAC, Gerlinde Kruse (Hrsg.): Nomenklatur der Organischen Chemie – Eine Einführung. 1. Auflage. Wiley-VCH, Weinheim 1997, ISBN 3-527-29327-2.
- Wolfgang Liebscher: Handbuch zur Anwendung der Nomenklatur organisch-chemischer Verbindungen. Akademie-Verlag, Berlin 1979, DNB 790313952.
- Wolfgang Holland: Die Nomenklatur in der organischen Chemie. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1973, DNB 730400123.
- Martin Negwer, Hans-Georg Scharnow: Organic chemical drugs and their synonymes, Vol. 1, 1–4138, Wiley–VCH–Verlag, Weinheim 2007, ISBN 978-3-527-31939-8.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- chemspider.com, Datenbank der Royal Society of Chemistry
- NIST Chemistry Webbook des National Institute of Standards and Technology
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-15.1 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ a b Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-33 (englisch, qmul.ac.uk [abgerufen am 29. März 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-15.2 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-15.3 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-15.4 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-15.5 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-15.6 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-13 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ a b Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-44 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ a b c Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-2 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ Hantzsch-Widman Nomenclature. Abgerufen am 29. März 2024.
- ↑ a b c d e Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-25 (englisch, qmul.ac.uk [abgerufen am 13. Januar 2024]).
- ↑ Appendix 1. Abgerufen am 13. März 2024.
- ↑ a b c G. P. Moss: Fused Ring Nomenclature. IUPAC Commission on Nomenclature of Organic Chemistry, 1998, abgerufen am 10. März 2024 (englisch).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-23 (englisch, qmul.ac.uk [abgerufen am 13. Januar 2024]).
- ↑ G. P. Moss: von Baeyer Nomenclature. IUPAC, 1999, abgerufen am 29. März 2024 (englisch).
- ↑ W. H. Powell: Phane Nomenclature. IUPAC, 1998, abgerufen am 27. März 2024 (englisch).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-24 (englisch, qmul.ac.uk [abgerufen am 2. Dezember 2024]).
- ↑ G. P. Moss: Extension and Revision of the Nomenclature for Spiro Compounds. IUPAC, 1999, abgerufen am 27. März 2024 (englisch).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-3 (englisch, qmul.ac.uk [abgerufen am 30. März 2024]).
- ↑ a b Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-31.1 (englisch, qmul.ac.uk [abgerufen am 29. Februar 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-14.7 (englisch, qmul.ac.uk [abgerufen am 24. März 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-31.2 (englisch, qmul.ac.uk [abgerufen am 27. März 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-14.5 (englisch, qmul.ac.uk [abgerufen am 29. März 2024]).
- ↑ a b Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-32 (englisch, qmul.ac.uk [abgerufen am 29. März 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-32 (englisch, qmul.ac.uk [abgerufen am 29. März 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-35 (englisch, qmul.ac.uk [abgerufen am 18. Dezember 2024]).
- ↑ a b Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-14.3 (englisch, qmul.ac.uk [abgerufen am 29. März 2024]).
- ↑ a b Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-14.4 (englisch, qmul.ac.uk [abgerufen am 30. November 2024]).
- ↑ Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-14.2 (englisch, qmul.ac.uk [abgerufen am 25. Oktober 2024]).
- ↑ a b Gerlinde Kruse: Nomenklatur der Organischen Chemie. Wiley, 1997, ISBN 978-3-527-29327-8, S. 2 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Blue Book chapter P-2: Blue Book chapter P-2, abgerufen am 23. Oktober 2023.
- ↑ Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 2013, ISBN 978-3-642-58368-1, S. 61 (books.google.de).
- ↑ Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieter Hellwinkel: Die systematische Nomenklatur der organischen Chemie – Eine Gebrauchsanweisung. Springer-Verlag, 2013, ISBN 978-3-662-06684-3, S. 3 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 63–66 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Gerlinde Kruse: Nomenklatur der Organischen Chemie: Eine Einführung. Wiley-VCH, 1997, ISBN 3-527-29327-2, S. 3,85.
- ↑ a b Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-16.5 (englisch, qmul.ac.uk [abgerufen am 26. November 2024]).
- ↑ a b c d e f Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 2013, ISBN 978-3-642-58368-1, S. 55 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Henri A. Favre, Warren H. Powell (Hrsg.): Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Soc. of Chemistry [u. a.], Cambridge 2014, ISBN 978-0-85404-182-4, Kapitel P-93.4 (englisch, qmul.ac.uk [abgerufen am 30. November 2024]).
- ↑ IUPAC: Nomenclature of Lipids: Recommendations Lip-1 and Lip-2.
- ↑ Chemical Substances – CAS REGISTRY. In: support.cas.org. Abgerufen am 2. April 2018.