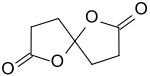
1,6-Dioxaspiro(4.4)nonan-2,7-dion
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,6-Dioxaspiro[4.4]nonan-2,7-dion (IUPAC) | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H8O4 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 156,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in kaltem, wenig löslich in heißem Wasser, leicht löslich in Chloroform, Aceton, Diethylether, Ethanol, Benzol und Ethylacetat, wenig löslich in Schwefelkohlenstoff, Methanol und Eisessig[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
1,6-Dioxaspiro[4.4]nonan-2,7-dion oder Spirodilacton ist eine von der Dicarbonsäure 4,4-Dihydroxypimelinsäure abgeleitete Spiroverbindung, die durch zweifache innere Esterbildung zu einem symmetrischen Dilacton entsteht. Der Kurzname Spirodilacton wird gelegentlich auch für das benzanellierte Spiro[2-benzofuran-3,5'-oxolan]-1,2'-dion verwendet. Die außerordentlich einfache Zugänglichkeit von 1,6-Dioxaspiro[4.4]nonan-2,7-dion aus der Plattformchemikalie Bernsteinsäure könnte der Verbindung interessante Zukunftsperspektiven eröffnen. Das Dilacton ist bereits als Ausgangsstoff für den Heterocyclus Pyrrolizidin, für das Polyol 3-Hydroxymethyl-1,3,6-hexantriol, für Ester der γ-Ketopimelinsäure und als Dicarbonsäurederivat für funktionelle Polymere, wie Polyether und Polyamide beschrieben.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]1,6-Dioxaspiro[4.4]nonan-2,7-dion (hier als Dilacton der Acetondiessigsäure oder Hydrochelidonsäure bezeichnet) wurde erstmals 1889 von J. Volhard beim Erhitzen von Bernsteinsäure oder Bernsteinsäureanhydrid und Abspaltung von Kohlendioxid erhalten[2] und 1892 weiter charakterisiert.[5]

Zwar geht die bei der Reaktion eingesetzte Bernsteinsäure bzw. ihr Anhydrid „zum großen Theil in einen neutralen, schön krystallisirenden Körper über“[2], ein erheblicher Rest besteht allerdings aus dunkel gefärbten „öligen und harzigen Zersetzungsproducten“, aus dem das reine Spirodilacton nur durch Vakuumdestillation und (mehrfacher) Umkristallisation erhalten werden kann.
In jüngeren Publikationen wird der Zusatz von geringen (katalytischen) Mengen von festem Kaliumhydroxid zum Bernsteinsäureanhydrid angegeben.[3]
Bei Verkürzung der Reaktionsdauer[6] und Wechsel zur kontinuierlichen Fahrweise[7] können Ausbeuten > 80 % erzielt werden.
In einer „Safety Note“[8] wird davor gewarnt, dass die unbeaufsichtigte Reaktion (mehrstündiges Erhitzen im Heizpilz auf 185 °C) zur explosionsartigen Zersetzung des Reaktionsansatzes führen kann.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1,6-Dioxaspiro[4.4]nonan-2,7-dion liegt als Reinsubstanz in großen, farblosen, durchsichtigen prismatischen Kristallen[2] vor, die sich in vielen organischen Lösungsmitteln lösen. Zur Reinigung kann es aus 95 % Ethanol umkristallisiert werden.[3] Im wässrigen Medium erfolgt Hydrolyse zu 4-Oxoheptandisäure.

Bei der Ringöffnung bilden sich zwei geminale Hydroxygruppen am Kohlenstoffatom in 4-Position, die gemäß der Erlenmeyer-Regel unter Wasserabspaltung in eine Carbonylgruppe übergehen.
Anwendungen
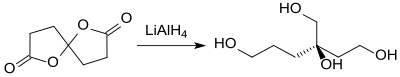
[Bearbeiten | Quelltext bearbeiten]Reduktion von Spirodilacton mit Lithiumaluminiumhydrid (LiAlH4) erzeugt den vierwertigen Alkohol 3-Hydroxymethyl-1,3,6-hexantriol in guter Ausbeute (89 %).[9]
Als Dilacton lässt sich 1,6-Dioxaspiro[4.4]nonan-2,7-dion mit Alkoholen unter Öffnung der Ringstrukturen zu Diestern der 4-Oxoheptandisäure umestern, die mit 2-Ethylhexanol als Alkoholkomponente als ausgezeichnete Weichmacher für Kunststoffe, wie z. B. Polyvinylchlorid PVC (Verbindung (A), mit 2-Methoxyethanol als hochwirksame wasserlösliche Abbeizmittel (Verbindung (B) beschrieben werden.[10]

Aus 1,6-Dioxaspiro[4.4]nonan-2,7-dion ist Pyrrolizidin, die Stammverbindung der lebertoxischen Pyrrolizidinalkaloide, in industriellen Mengen einfach zugänglich.[6]
Besonders intensiv wurde um das Jahr 1990 die Eignung von 1,6-Dioxaspiro[4.4]nonan-2,7-dion als Dicarbonsäureäquivalent für Polymere mit duroplastische[11] wie thermoplastische[12] Eigenschaften untersucht. Die durch Umsetzung von Spirodilacton mit primären funktionellen Aminen zugänglichen Spirodilactame sind sehr starre und temperaturbeständige Molekülbausteine für Hochleistungspolymere.[13]
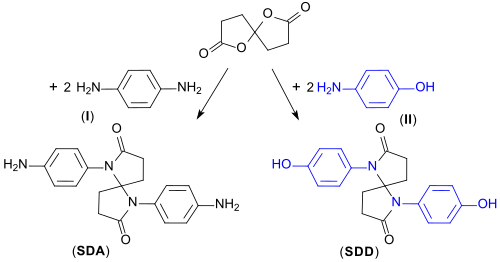
Mit p-Phenylendiamin (I) entsteht das Spirodilactam-dianilin (SDA), mit 4-Aminophenol das Spirodilactam-diphenol (SDD). Insbesondere das Diphenolderivat (SDD) wurde als Ausgangsverbindung für Thermoplaste auf der Basis von u. a. Epoxiden oder Bismaleimiden eingehender bearbeitet und als möglicher Ersatz für Bisphenol A (BPA) identifiziert. Die daraus hergestellten Polymere zeichnen sich durch um ca. 80 °C höhere Glastemperaturen Tg im Vergleich zur Referenz BPA aus.[13]
Mit fluorsubstituierter Aromaten wurden thermoplastische aromatische Polyether und Polyetherketone synthetisiert, die sehr hohe Glastemperaturen (>240 °C), geringe Wasseraufnahmen und niedrige Dielektrizitätskonstanten aufweisen und bis über 500 °C thermisch stabil sind.[14]
Die einfache Zugänglichkeit aus in jüngster Zeit preislich wettbewerbsfähiger Bernsteinsäure[15] aus nachwachsenden Rohstoffen[16] und die interessanten Eigenschaften als Building Block für kleine Moleküle und Polymere könnten zukünftigen Forschungen über 1,6-Dioxaspiro[4.4]nonan-2,7-dion neue Impulse geben.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt 1,6-Dioxaspiro[4.4]nonan-2,7-dion bei Sigma-Aldrich, abgerufen am 15. Januar 2022 (PDF).
- ↑ a b c d e J. Volhard: Ueber Acetondiessigsäure oder Hydrochelidonsäure. In: Liebigs Ann. Chem. Band 253, Nr. 1, 1889, S. 206–239, doi:10.1002/jlac.18892530119.
- ↑ a b c R.J. Pariza, F. Kuo, P.L. Fuchs: An improved procedure for the synthesis of 4-oxopimelate-derived materials. In: Synth. Commun. Band 13, Nr. 3, 1983, S. 243–254, doi:10.1080/00397918308065996.
- ↑ a b 1,6-Dioxaspiro[4.4]nonane-2,7-dione. (PDF; 42 kB) Oakwood Products, abgerufen am 10. März 2022 (englisch).
- ↑ J. Volhard: Ueber Hydrochelidonsäure und Acetondiessigsäure. Zweite Abhandlung. In: Liebigs Ann. Chem. Band 267, Nr. 1, 1892, S. 48–106, doi:10.1002/jlac.18922670103.
- ↑ a b Patent DE2136886: Verfahren zur Herstellung von Pyrrolizidinen. Angemeldet am 23. Juli 1971, veröffentlicht am 1. Februar 1973, Anmelder: BASF AG, Erfinder: W. Mesch, D. Voges, S. Winderl.
- ↑ Patent DE753472: Verfahren zur Herstellung von γ-Ketopimelinsäuredilacton. Veröffentlicht am 19. Oktober 1941, Anmelder: I.G. Farbenindustrie AG, Erfinder: F. Ebel, F. Pyzik, G. Pöhler.
- ↑ M.S. Hoekstra: Safety Note. In: Synth. Commun. Band 14, Nr. 14, 1984, S. 1379–1380, doi:10.1080/00397918408057679.
- ↑ M. Päri, M. Lüll, A. Paju, T. Pekh, M. Lopp: Synthesis of 3-hydroxymethyl-1,3,6-hexanetriol from chiral spirodilactone. In: ICOS 2006. 2006, S. 129 (etis.ee).
- ↑ Patent US2665303: Esters of gamma-ketopimelic acid. Angemeldet am 28. Juli 1949, veröffentlicht am 1. Mai 1954, Anmelder: Monsanto Chemical Co., Erfinder: H.R. Gamrath.
- ↑ Patent US4939251: Novel spirolactones. Angemeldet am 16. September 1988, veröffentlicht am 3. Juli 1990, Anmelder: Shell Oil Co., Erfinder: P.C. Wang.
- ↑ Patent US5034504: Spirolactam polyamide polymer. Angemeldet am 14. Mai 1990, veröffentlicht am 23. Juli 1991, Anmelder: Shell Oil Co., Erfinder: P.C. Wang.
- ↑ a b P.-C. Wang, W.J. Asbell, H.H. Chuah, W.P. Gergen: Polyspirolactam: A new family of high temperature polymers. In: Polym. Engin. Sci. Band 34, Nr. 1, 1994, S. 6–11, doi:10.1002/pen.760340105.
- ↑ H. Zhou, E. Bucio, S.R. Venumbaka, J.W. Fitch, P. Cassidy: New spirolactam polymer. In: Polymer. Band 47, 2006, S. 6927–6930, doi:10.1016/j.polymer.2006.07.040.
- ↑ E. Mancini et al.: Economic and environmental analysis of bio-succinic acid production: From established processes to a new continuous fermentation approach with in-situ electrolytic extraction. In: Chem. Eng. Res. Des. Band 179, 2022, S. 401–414, doi:10.1016/j.cherd.2022.01.040.
- ↑ R. Dickson, E. Mancini, N. Garg, J.M. Woodley, K.V. Gernaey, M. Pinelo, J. Liu, S.S. Mansouri: Sustainable bio-succinic acid production: superstructure optimization, techno-economic, and lifecycle assessment. In: Energy Environ. Sci. Band 14, Nr. 6, 2021, S. 3542–3558, doi:10.1039/D0EE03545A.
