Molaren-Inzisiven-Hypomineralisation
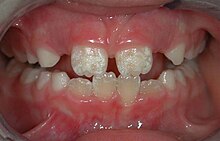
Die Molaren-Inzisiven-Hypomineralisation (MIH, englisch Molar incisor hypomineralization), im Volksmund auch „Kreidezähne“ genannt, ist eine spezielle Form der Schmelzbildungsstörung, nämlich einer systemisch bedingten Hypomineralisation der Sechsjahrmolaren (Zähne 16, 26, 36, 46) und/oder der oberen bleibenden Inzisivi (Schneidezähne). Es handelt sich um eine Variante der Strukturstörungen der Zahnhartsubstanz (Zahnschmelz).
Endogen bedingte Strukturstörung
[Bearbeiten | Quelltext bearbeiten]Die Molare-Inzisive-Hypomineralisation gehört zu den endogen bedingten Strukturstörungen, die als Folge eines temporären Mangelzustandes oder einer direkten Funktionsbeeinträchtigung oder Schädigung der normal angelegten zahnbildenden Zellen auftreten. Die Störungen können prä-, peri- und postnatal eintreten. Daher können beide Dentitionen (sowohl Milchzähne, als auch bleibende Zähne) betroffen sein; die bleibenden Zähne sind dabei deutlich häufiger betroffen, insbesondere Zähne bzw. Zahngruppen, die zeitgleich mineralisieren. Die Strukturschädigung beschränkt sich auf eine bestimmte Entwicklungsphase der Zähne.
Ätiologie
[Bearbeiten | Quelltext bearbeiten]Der Einfluss auf die Mineralisation, der zur MIH führt, vollzieht sich hauptsächlich im ersten Lebensjahr. Die Ursache der MIH ist weitgehend ungeklärt. Der Evidenzgrad der Mehrzahl der bisherigen diesbezüglichen Studien ist niedrig. Es gibt Hinweise darauf, dass die Aufnahme von Dioxinen oder polychlorierten Biphenylen (PCB) mit der Muttermilch an der Ätiologie der MIH beteiligt sind.
Diese initialen Ergebnisse konnten jedoch nicht bestätigt werden und es ergaben sich keine Assoziationen zwischen Stillen und MIH.[1] Ernährung, Geburtszwischenfälle und zahlreiche akute oder chronische Kinderkrankheiten beziehungsweise deren Behandlung könnten eine Rolle spielen, wobei eine Amoxicillin- oder Erythromycingabe im ersten Lebensjahr das Risiko einer MIH-Entstehung deutlich erhöht.[2][3] Eine stärkere Verbreitung in nordeuropäischen Ländern gegenüber südlicheren Ländern spricht auch für einen Einfluss des Vitamin-D-Haushalts.[4]
Eine Studie zur Verbreitung und Verteilung von MIH in Deutschland ergab, dass die durchschnittliche Anzahl der von MIH betroffenen permanenten Zähne 2,8 ±1,7 betrug. Die meisten Zähne wiesen dabei umschriebene Opazitäten auf, aber gut die Hälfte der Kinder litten an der schweren Form mit Substanzverlust, atypischen Restaurationen oder Schmerzen. Es konnte ein eindeutiger Zusammenhang zu Veränderungen an zweiten Milchmolaren festgestellt werden und bei der schweren Form erhöhte sich auch im Durchschnitt die Anzahl der betroffenen Zähne. Ein Vergleich mit dem regionalen Antibiotikakonsum bei kleinen Kindern konnte keinen Zusammenhang zu Unterschieden in der MIH-Rate herstellen.[5]
Es besteht ein Zusammenhang zwischen Amelotin (AMTN) und Zahnschmelzdefekten und ihrer Entstehung. In Abwesenheit von AMTN entstehen schwache Stellen an den Zahnkanten, die leichter zerbrechen oder splittern. In diesem Fall findet die Mineralisierung des Zahnschmelzes verlangsamt statt. Im Reifestadium ist das Volumenwachstum der Kristalliten eingeschränkt, was wiederum zu einer Hypomineralisation führt.[6]
Klinisches Bild
[Bearbeiten | Quelltext bearbeiten]Die Mineralisationsstörung der betroffenen Zähne ist sehr variabel. Sie reicht von weiß-gelblichen oder gelb-braunen, abgegrenzten Opazitäten bis hin zu schweren Hypomineralisationen mit fehlenden Schmelz- und Dentinarealen von unterschiedlichen Ausmaßen.[7] Hypomineralisierte Zähne weisen häufig eine Hypersensibilität insbesondere auf Kältereize auf, die im Alltag zu einer natürlichen Schonhaltung führt, die oft von Eltern nicht wahrgenommen wird. Die Kinder leiden dadurch beträchtlich.
Schweregrade der Hypomineralisation
[Bearbeiten | Quelltext bearbeiten]| Grad | Beschreibung |
|---|---|
| Grad I | Einzelne cremefarbene bis braune Areale an Kauflächen/Höckerspitzen beziehungsweise an den vestibulären Flächen von Schneidezähnen. |
| Grad II | Überwiegend gelb-brauner Zahnschmelz, hypomineralisierte Bereiche über die Okklusalfläche hinaus beziehungsweise an der gesamten vestibulären Fläche von Schneidezähnen. Erhöhte Gefahr für Schmelzfrakturen und gesteigerte Empfindlichkeit der betroffenen Zähne |
| Grad III | Große gelblich-braune Areale im gesamten Zahnbereich. Gegebenenfalls Schmelzverluste oft vor dem vollständigen Durchbruch der Zähne. Hohe Empfindlichkeit der Zähne. |
| Klasse | Beschreibung |
|---|---|
| Klasse I | milde Defekte – farbliche Veränderungen |
| Klasse II | mäßige/moderate Defekte – isolierte Schmelzverluste |
| Klasse III | schwere Defekte – Schmelzverluste mit betroffenen Dentinanteilen |
Differentialdiagnose
[Bearbeiten | Quelltext bearbeiten]Man unterscheidet bei den Strukturstörungen der Zahnhartsubstanz zwischen exogen, endogen und genetisch bedingten Strukturstörungen. Verschiedene Theorien, wie zum Beispiel eine Antibiotikagabe während der Schwangerschaft, Bisphenol-A-Belastungen, Dioxine und Furane aus der Umwelt, ein bestehender Vitamin-D-Mangel und auch Infektionen mit Windpocken wurden als Ursache dafür diskutiert, dass Kinderzähne – vorwiegend die Sechsjahrmolaren oder die Schneidezähne – sich nicht normal entwickeln.
Exogen bedingte Strukturstörungen
[Bearbeiten | Quelltext bearbeiten]Exogen bedingte Strukturstörungen sind durch exogene, also äußere (entzündliche, traumatische oder strahlenphysikalische) Noxen an einzelnen Zahnkeimen verursacht. Dabei treten die Strukturstörungen solitär, asymmetrisch und überwiegend unilateral an einzelnen Zähnen oder Zahngruppen auf.
Genetisch bedingte Strukturstörungen
[Bearbeiten | Quelltext bearbeiten]Genetisch bedingte Strukturstörungen sind erblich bedingt. Man erkennt ein generalisierte Vorkommen in der ersten und zweiten Dentition. Die Familienanamnese kann hierbei Aufschluss geben, falls familiär vergleichbare Schäden an den Zähnen aufgetreten sind, die in gleicher Art und Weise betroffen sind. Hierzu gehört die Amelogenesis imperfecta.
Regionale Odontodysplasie
[Bearbeiten | Quelltext bearbeiten]Die regionale Odontodysplasie (Zahnmissbildung) gehört zu den nicht genetisch bedingten Strukturstörungen. Die Ursachen sind unbekannt. Vermutet werden eine Störung der Entwicklung mesenchymaler und ektodermaler Strukturen der Zähne, eine Störung in den Zellen der Neuralleiste, eine Infektion oder ein Mangel an vaskulärer Versorgung, wobei letztere Hypothese am weitesten verbreitet ist. Auch eine Strahlentherapie kann zur Odontodysplasie führen.[10] Von dieser Abnormalität betroffene Zähne können persistieren (nicht durchbrechen). Die Zähne sind kleiner, zeigen vermehrte Grübchen und Furchen und haben häufig eine braune bis gelbliche Verfärbung. Röntgenologisch erkennt man ein großes Pulpenlumen mit einem dünnen Hartsubstanzmantel, das Wurzelwachstum ist verzögert, Schmelz und Dentin lassen sich kaum voneinander abgrenzen, die Radioopazität (Strahlenundurchlässigkeit) ist vermindert. Auf Röntgenbildern erscheinen diese Zähne oft durchsichtig und verwaschen, was ihnen den Namen Ghost teeth (engl.: Geisterzähne) eingebracht hat.[11]
Dentalfluorose
[Bearbeiten | Quelltext bearbeiten]Während Fluorid in einer Dosierung von ca. 1 mg/Tag als ein wirksames Mittel zur Kariesprophylaxe (Fluoridierung) angesehen wird, erzeugt es in höheren, systemisch während der Zahnbildung aufgenommenen Dosen die Zahnfluorose, bei der sich weiße bis braune Verfärbungen in Form von Flecken oder Streifen auf der Zahnschmelzoberfläche bilden.
Tetracyclin-Zähne
[Bearbeiten | Quelltext bearbeiten]Bei Schwangeren (da Tetracycline die Plazentaschranke frei passieren) und Stillenden sind Tetracycline kontraindiziert, da sie mit Calcium in irreversibler Komplexbildung in den kindlichen Zahnschmelz (und Knochen) eingebaut werden. Dies führt zu einer erhöhten Frakturanfälligkeit und brauner Verfärbung der Zähne. Erst ab einem Lebensalter von 10 bis 12 Jahren können Tetracycline auch bei Kindern angewendet werden. Nicht gesichert ist, ob Tetracycline auch Schmelzhypoplasien verursachen können. Eine Tetracyclintherapie soll deshalb u. a. in der Therapie der Akne bei Kindern und Jugendlichen nicht eingesetzt werden.[12][13]
Therapie
[Bearbeiten | Quelltext bearbeiten]Lokalanästhetika haben an diesen Zähnen häufig nur eine eingeschränkte Wirkung, woraus eine Behandlung meist nur unter Analgosedierung oder in Allgemeinanästhesie möglich ist. Als Füllungs- bzw. Ersatzwerkstoffe bei MIH-Zähnen sind Komposite, Konfektionierte Metallkronen, Glasionomerzement (nur als temporäre Füllung) geeignet. Nicht empfehlenswert ist die Verwendung von Amalgam wegen der hohen Kälte-/Wärmeleitfähigkeit dieser temperaturempfindlichen Zähne und weil der heranwachsende Organismus möglichst keinen zusätzlichen Schwermetallbelastungen ausgesetzt sein soll. Bei nur geringen Defekten kann eine Fissurenversiegelung ausreichend sein (Grad I). Überempfindlichkeit nach Füllungstherapie können durch korrekte Anwendung des Adhäsivsystems und der dadurch erreichten vollständigen Versiegelung der Dentinkanälchen vermieden werden. Engmaschige Nachsorgetermine im Abstand von drei bis vier Monaten einschließlich professioneller Zahnreinigung und regelmäßiger lokaler Fluoridierung (für die Kariesprophylaxe) werden empfohlen.
Extraktionen der hypomineralisierten 6-Jahr-Molaren sind sinnvoll, wenn schnell fortschreitende Abplatzungen der Zahnhartsubstanzen zu diagnostizieren sind, es sich um einen Platzmangel handelt, der sowieso eine kieferorthopädische Behandlung nach sich zieht oder die Mundhygiene aufgrund der ausgeprägten Temperaturempfindlichkeit stark eingeschränkt ist.[14]
Die definitive Versorgung der Defekte erfolgt im frühen Erwachsenenalter mittels Zahnkronen.
Ergänzend zu der herkömmlichen Mund- und Zahnpflege können Produkte mit Calciumphosphaten (z. B. amorphes Calciumphosphat/ACP, Tricalciumphosphat, Hydroxylapatit) verwendet werden, um eine mögliche Nachreifung der Hypomineralisationen zu erreichen.[15][16][17]
Begriffshistorie
[Bearbeiten | Quelltext bearbeiten]Der Begriff der Molaren-Inzisiven-Hypomineralisation wird seit dem Kongress der European Academy of Paediatric Dentistry (EAPD, der Europäischen Akademie für Kinderzahnheilkunde)[18] im Jahre 2001 verwendet. Zuvor wurden diese Strukturstörungen als nicht endemische Schmelzflecken,[19] Idiopathische Schmelzhypomineralisation der ersten Molaren,[20] Cheese molars[21] oder nicht fluoridbedingte Hypomineralisationen der ersten Molaren,[22] beziehungsweise auch als Molare-Inzisive-Hypoplasie bezeichnet.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Verena Knapp, Silke Nies: Molar-Incisor-Hypomineralization. In: Zahnmedizin up2date. Band 3, Nr. 05, Oktober 2009, S. 491–510, doi:10.1055/s-0029-1185707.
- N.-M. Kellerhoff, A. Lussi Die «Molaren-Inzisiven-Hypomineralisation» (PDF; 158 kB) In: Schweiz. MonatsschrZahnmed, Vol 114, 3/2004, S. 244–249.
- P. Fischer, V. Bardenheuer et al.: Molaren-Inzisiven-Hypomineralisation (PDF) In: Bayer. Zahnärzteblatt, 05/2009, S. 54–58.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Zahnschmelzstörung gibt Rätsel auf, Focus online, 23. Oktober 2014
- Ireme Berres: Kreidezähne bei Kindern Zahnärzte warnen vor neuer Volkskrankheit. Spiegel Online, 24. Mai 2018
- Antibiotika könnten „Kreidezähne“ verursachen, Tagesschau.de, 1. Juni 2021
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Jan Kühnisch, Marie Standl, Reinhard Hickel, Joachim Heinrich: Molaren-Inzisiven-Hypomineralisation (MIH). Häufigkeit und mögliche Ursachen unter besonderer Berücksichtigung der Ergebnisse aus den Münchner Geburtskohorten GINIplus und LISA. In: Bundesgesundheitsblatt, Gesundheitsforschung, Gesundheitsschutz. Band 64, Nr. 8, 2021, S. 924, doi:10.1007/s00103-021-03366-1, PMID 34213569, PMC 8316183 (freier Volltext).
- ↑ F. Crombie, D. Manton, N. Kilpatrick: Aetiology of molar-incisor hypomineralization: a critical review. In: International journal of paediatric dentistry / the British Paedodontic Society [and] the International Association of Dentistry for Children. Band 19, Nummer 2, März 2009, S. 73–83, doi:10.1111/j.1365-263X.2008.00966.x, PMID 19250392. (Review).
- ↑ S. Laisi, H. Kiviranta u. a.: Molar-incisor-hypomineralisation and dioxins: new findings. In: European archives of paediatric dentistry: official journal of the European Academy of Paediatric Dentistry. Band 9, Nummer 4, Dezember 2008, S. 224–227, PMID 19054476.
- ↑ AB: MIH: Ursachen der Mineralisationsstörung bei Kindern unbekannt. In: dentalmagazin.de. 8. Juni 2015, abgerufen am 7. März 2019.
- ↑ M. A. Petrou, Prevalence of Molar-Incisor-Hypomineralisation (MIH) among German school children at four cities in Germany: an epidemiological study (PDF) Dissertation, Universität Greifswald (2013)
- ↑ Y. Nakayama, J. Holcroft, B. Ganss: Enamel Hypomineralization and Structural Defects in Amelotin-deficient Mice. In: Journal of dental research. Band 94, Nummer 5, 2015, S. 697–705, doi:10.1177/0022034514566214, PMID 25715379.
- ↑ M. Schüler, R. Heinrich-Weltzien, Diagnostik und Therapie von Strukturstörungen der Zahnhartsubstanz im Kindes- und Jugendalter ( des vom 3. Dezember 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., ZMK, Spitta Verlag (2010)
- ↑ W. E. Wetzel, U. Reckel, Fehlstrukturierte Sechsjahrmolaren nehmen zu – eine Umfrage. Zahnärztl Mitt 1991; 81: 650–652
- ↑ S. Alaluusua, P. L. Lukinmaa u. a.: Polychlorinated dibenzo-p-dioxins and dibenzofurans via mother’s milk may cause developmental defects in the child’s teeth. In: Environmental Toxicology and Pharmacology. Bd. 1, Nummer 3, Mai 1996, S. 193–197, PMID 21781681.
- ↑ B. W. Neville et al.: Oral & Maxillofacial Pathology. 2. Auflage. (2002) S. 99
- ↑ M. A. Kahn: Basic Oral and Maxillofacial Pathology (2001) S. 88
- ↑ S. Q. Cohlan: Tetracycline staining of teeth. In: Teratology. Bd. 15, Nummer 1, Februar 1977, S. 127–129, doi:10.1002/tera.1420150117, PMID 841479.
- ↑ L. G. Antonini, H. U. Luder: Discoloration of teeth from tetracyclines–even today? In: Schweizer Monatsschrift für Zahnmedizin = Revue mensuelle suisse d’odonto-stomatologie = Rivista mensile svizzera di odontologia e stomatologia / SSO. Bd. 121, Nummer 5, 2011, S. 414–431, PMID 21656385.
- ↑ S. A. Fayle: Molar incisor hypomineralisation: restorative management. In: European journal of paediatric dentistry: official journal of European Academy of Paediatric Dentistry. Bd. 4, Nummer 3, September 2003, S. 121–126, PMID 14529331 (Review).
- ↑ C. Baroni, S. Marchionni: MIH Supplementation Strategies. In: Journal of Dental Research. Band 90, Nr. 3, 2011, S. 371–376, doi:10.1177/0022034510388036.
- ↑ F. Meyer, J. Enax: Early Childhood Caries: Epidemiology, Aetiology, and Prevention. In: International Journal of Dentistry. Band 2018, 2018, doi:10.1155/2018/1415873.
- ↑ Frederic Meyer, Bennett T. Amaechi, Helge-Otto Fabritius, Joachim Enax: Overview of Calcium Phosphates used in Biomimetic Oral Care. In: The Open Dentistry Journal. Band 12, 31. Mai 2018, ISSN 1874-2106, S. 406–423, doi:10.2174/1874210601812010406, PMID 29988215, PMC 5997847 (freier Volltext).
- ↑ European Academy of Paediatric Dentistry
- ↑ D. JACKSON: A clinical study of non-endemic mottling of enamel. In: Archives of oral biology. Band 5, Dezember 1961, S. 212–223, PMID 13957195.
- ↑ G. Koch, A. L. Hallonsten u. a.: Epidemiologic study of idiopathic enamel hypomineralization in permanent teeth of Swedish children. In: Community dentistry and oral epidemiology. Band 15, Nummer 5, Oktober 1987, S. 279–285, PMID 3477361
- ↑ W. E. van Amerongen, C. M. Kreulen: Cheese molars: a pilot study of the etiology of hypocalcifications in first permanent molars. In: ASDC journal of dentistry for children. Band 62, Nummer 4, 1995, S. 266–269, PMID 7593885
- ↑ E. C. Lo, C. G. Zheng, N. M. King: Relationship between the presence of demarcated opacities and hypoplasia in permanent teeth and caries in their primary predecessors. In: Caries Research. Band 37, Nummer 6, 2003, S. 456–461, doi:10.1159/000073400, PMID 14571126