Laktoseintoleranz
| Klassifikation nach ICD-10 | |
|---|---|
| E73 | Laktoseintoleranz |
| ICD-10 online (WHO-Version 2019) | |

Bei Laktoseintoleranz oder Milchzuckerunverträglichkeit wird der mit der Nahrung aufgenommene Milchzucker als Folge fehlender oder verminderter Produktion des Verdauungsenzyms Lactase nicht oder unvollständig verdaut; daraus kann sich eine Unverträglichkeit für Milch und Milcherzeugnisse ergeben. Eine Laktoseintoleranz ist bei Kindern unter fünf Jahren sehr selten. Meist entwickelt sie sich erst im Jugend- und Erwachsenenalter.
Weltweit ist Laktoseintoleranz sehr verbreitet, wobei es je nach Region und Bevölkerung deutliche Unterschiede gibt: Während die Inzidenz in Afrika und Ostasien bei 65 bis über 90 % der Erwachsenen liegt,[1] sind es etwa 5 bis 15 % unter Europäern[1] und ebenfalls 5–15 % bei hellhäutigen Menschen in Australien und Nordamerika.[2] In Deutschland gibt es laut Bundeszentrum für Ernährung etwa 15 % Laktoseintolerante.[3] Am seltensten ist die Laktoseintoleranz in Nordeuropa.
Allgemeines
[Bearbeiten | Quelltext bearbeiten]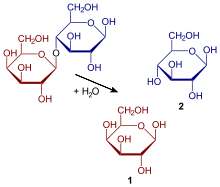
Alle (gesunden) neugeborenen Säugetiere bilden während des Säugens (Säuglinge in der Stillzeit) das Enzym Laktase, welches das nicht resorbierbare Disaccharid Milchzucker in die verwertbaren Einfachzucker D-Galaktose und D-Glukose spaltet. Laktase wird dazu in der Dünndarmschleimhaut (vor allem im Jejunum) gebildet[4] und ist Inhaltsstoff des Darmsafts; sie ermöglicht dem Neugeborenen die Nutzung der milchzuckerreichen Muttermilch als Hauptenergiequelle.
Im Laufe der natürlichen Entwöhnung von der Muttermilch sinkt die Aktivität der Laktase auf etwa 5–10 % der Aktivität bei der Geburt.[5] Das gilt für den Menschen und alle anderen Säugetiere. Nur bei Populationen, die seit langer Zeit Milchwirtschaft betreiben,[6] hat sich als vermutlicher Selektionsvorteil[7] eine Mutation durchgesetzt, die dazu führt, dass auch noch im Erwachsenenalter genügend Laktase produziert wird; dies wird als Laktasepersistenz bezeichnet. Die Laktasepersistenz der Nordeuropäer entstand durch eine Genmutation vor ungefähr 7000 Jahren,[8][9] nach anderen Erkenntnissen sogar erst während der letzten 5000 Jahre.[10]
Symptome
[Bearbeiten | Quelltext bearbeiten]Bei mangelhafter Laktaseaktivität gelangt ungespaltener Milchzucker beim Menschen bis in den Dickdarm, wo er von Darmbakterien aufgenommen und vergoren wird. Als Gärungsprodukte entstehen meist kurz nach dem Verzehr Laktat (Salz der Milchsäure) und die Gase Kohlendioxid (CO2), Methan (CH4) und Wasserstoff (H2). Die Gase führen unter anderem zu Völlegefühl, Unterbauchschmerzen, Blähungen und die ebenfalls gebildeten kurzkettigen Fettsäuren zu Übelkeit mit Erbrechen. Die osmotisch aktive Milchsäure bewirkt einen Wassereinstrom in den Darm mit Durchfall (osmotische Diarrhoe).[1]
Ähnliche Symptome kommen bei Menschen mit einer Intoleranz für Fruchtzucker (Fruktose), der sogenannten Fruktosemalabsorption vor; Ähnlichkeiten bestehen auch mit dem Reizdarmsyndrom.
Ursachen
[Bearbeiten | Quelltext bearbeiten]Laktoseintoleranz kann verschiedene Ursachen haben:
- Primärer (natürlicher) Laktasemangel: Bei Säuglingen wird dieses Verdauungsenzym normalerweise in ausreichender Menge produziert. Nach einigen Jahren verringert sich die erzeugte Laktasemenge, jedoch je nach Population unterschiedlich: Während z. B. ein Großteil der erwachsenen mittel- und südasiatischen Bevölkerung keine Milchprodukte mehr verträgt, bereitet in nördlichen Bereichen (bei den meisten Bewohnern Europas und des Nahen Ostens oder Menschen europäischer und nahöstlicher Abstammung sowie den sibirischen und mongolischen Ethnien) die Milchzuckeraufnahme meistens bis ins hohe Alter keine Probleme. Grund für das Versiegen der Enzymproduktion im Erwachsenenalter ist ein Polymorphismus (Single Nucleotide Polymorphism) auf dem langen Arm des Chromosoms 2 (2q21) im Promotorbereich des Laktase-Gens: CC-Genotyp des C/T-13910-Polymorphismus oder GG-Genotyp des G/A-22018-Polymorphismus.[11]
- Sekundäre (erworbene oder vorübergehende) Laktoseintoleranz (nach Leiß 2005[12]), z. B. durch folgende Ursachen:
- Erkrankungen des Verdauungssystems können, besonders während der Kindheit, die laktaseproduzierenden Zellen im Dünndarm so schädigen, dass vorübergehend die Laktaseproduktion beeinträchtigt ist; nach dem Auskurieren verschwindet dieser Mangel meist völlig. In seltenen Fällen sind die laktaseproduzierenden Gewebe so geschädigt, dass sie sich nicht mehr erholen, und es kommt zu einer chronischen Laktoseintoleranz.
- bakterielle oder virale Gastroenteritis
- chronische Darmerkrankungen
- Zöliakie/Sprue
- intestinales Lymphom
- partielle oder totale Gastrektomie
- Kurzdarmsyndrom
- Blindsacksyndrom/großes Duodenaldivertikel
- Chemotherapie/Strahlentherapie
- Mangelernährung
- chronischer Alkoholmissbrauch
- Dünndarmparasiten aus der Gruppe der Giardien (wie Giardia intestinalis)[13]
Selten:
- Angeborener Laktasemangel (absolute Laktoseintoleranz): Aufgrund eines Gendefektes ist die Laktasebildung stark eingeschränkt, oder es kann überhaupt kein Enzym gebildet werden (so genannte Alaktasie). Die Vererbung erfolgt autosomal-rezessiv. Es handelt sich um eine seltene Erbkrankheit, die bereits in den ersten Tagen nach der Geburt an Durchfall erkennbar ist.[14]
- Ein Teil der mit angeborener Laktoseintoleranz diagnostizierten Säuglinge leidet möglicherweise an einer seltenen Störung, bei der Laktose unverdaut bereits vom Magen aufgenommen wird, in die Blutbahn gelangt (Laktosämie) und mit dem Urin ausgeschieden wird (Laktosurie). Da unverdaute Laktose im Blut schädlich ist, kann die Störung unerkannt zu Vergiftungserscheinungen mit Katarakt, Leber- und Hirnschäden führen.[15][16][17][18]
Diagnose
[Bearbeiten | Quelltext bearbeiten]Eine Selbstdiagnose von Laktoseintoleranz lässt sich mit einer Testfolge durchführen:
- Diättest: Eine mehrtägige konsequente Diät ohne Laktose, vor allem ohne Milch, Rahm und „versteckte“ Laktose (viele Fertigprodukte enthalten Milchzucker oder Milchbestandteile). Treten in dieser Zeit keine Symptome mehr auf, ist eine Laktoseintoleranz möglich.
- Expositionstest: Nach einigen Tagen Laktose-Verzicht wird ein Glas Wasser mit 50 bis 100 g gelöstem Milchzucker getrunken. Treten danach innerhalb von einigen Stunden die typischen Symptome auf, besteht wahrscheinlich eine Laktoseintoleranz.
Häufig ist die Diagnose nicht eindeutig, da nur eine unvollständige Intoleranz besteht. Beim primären Lactasemangel nimmt die Unverträglichkeit im Verlauf des Lebens zu, nicht so bei dem angeborenen Lactasemangel.
Folgende Tests sind aufwändiger:
- H2-Atem-Test:[19][20] Dieses Verfahren basiert auf dem Nachweis von Wasserstoff (H2) in der Ausatemluft. Es ist ein indirekter Nachweis des Laktasemangels. Bei der bakteriellen Aufarbeitung der Laktose im Dickdarm entsteht neben Milchsäure, Essigsäure und Kohlenstoffdioxid auch gasförmiger Wasserstoff. Dieser gelangt über das Blut in die Lungen und wird abgeatmet. Da normalerweise kein Wasserstoff in der Ausatemluft vorhanden ist, deutet ein positives Ergebnis auf eine mögliche Laktoseintoleranz hin. Gemessen wird bei diesem Test die Wasserstoffkonzentration vor und nach der oralen Verabreichung einer definierten Menge an Laktose (Milchzucker). Als positiv gilt der Befund, wenn nach der Laktosegabe eine um 20 ppm erhöhte Wasserstoffkonzentration gemessen wird. Allerdings führt dieser Test bei jedem fünften Laktoseintoleranten zu einem negativen Ergebnis: Bei diesen Patienten erzeugen besondere Bakterien der Darmflora Methan aus Kohlenstoffdioxid auf Kosten des entstandenen Wasserstoffs.
- Blutzucker-Test: Dieses Verfahren basiert auf der Messung des Glukose-Gehalts im Blut (venöses Blut oder Kapillarblut), die Laktaseaktivität wird also über einen Anstieg der Konzentration an Glukose im Blut festgestellt. Da normalerweise Laktose in Galaktose und Glukose gespalten wird, müsste der Glukosewert (Blutzuckerwert) ansteigen, wenn Laktose eingenommen wird. Ist dies nicht der Fall, liegt der Verdacht einer Laktoseintoleranz nahe. Auch bei diesem Test nimmt der Patient auf nüchternen Magen eine definierte Menge an Laktose (üblicherweise 50 Gramm aufgelöst in einem halben Liter stillem Wasser) zu sich. Vor der Einnahme sowie zwei Stunden lang alle 30 Minuten nach der Einnahme erfolgt eine Blutprobe und es wird der Blutzuckergehalt gemessen. Normal ist ein Anstieg von über 20 mg/dl (1,11 mmol/l) Glukose in venösem Blut oder von 25 mg/dl in Kapillarblut.
- Gentest: Seit kurzem kann bei Verdacht auf Laktoseintoleranz ein Gentest auf den LCT-Genotyp durchgeführt werden. Als Untersuchungsmaterial dient eine einfache Blutprobe.[21]
- Biopsie: In seltenen Fällen muss eine Gewebeprobe aus dem Dünndarm entnommen und untersucht werden. Hier wird die Lactaseaktivität im Dünndarmgewebe untersucht.
Maldigestion und Auftreten von Symptomen
[Bearbeiten | Quelltext bearbeiten]Klinische Studien haben gezeigt, dass der primäre Lactasemangel (Non-Persistenz) und die daraus folgende Verdauungsschwäche für Milchzucker (über die erstmals zu Beginn des 19. Jahrhunderts wissenschaftlich berichtet wurde,[22]) nicht notwendig zu den bekannten Symptomen einer Lactoseintoleranz führen.[23][24] Die meisten Menschen mit primärem Lactasemangel vertragen symptomfrei bis zu 12 g Milchzucker, was ungefähr einem Glas Milch (200 ml) entspricht.[25] Von Lactasemangel-Probanden, die nach der Einnahme von 25 g Milchzucker einen signifikant erhöhten Atem-Wasserstoff aufwiesen, vertrug ungefähr die Hälfte diese Menge symptomfrei.[23] Außerdem gibt es Personen, die Milchzucker zwar gut verdauen, aber trotzdem Symptome von Intoleranz zeigen, sowie Personen mit Lactasemangel, deren Symptome auch mit milchzuckerfreier Milch bestehen bleiben.[23] Obwohl durch kontinuierlich aufgenommenen Milchzucker die Aktivität der Darmlactase nicht erhöht wird, kann damit sowohl eine Verminderung des Atem-Wasserstoffs als auch der gastrointestinalen Symptome erzielt werden. Anpassungen der Dickdarmfunktionen (Motilität, Transit und pH-Wert) und eine damit verbundene verringerte Wahrnehmung der Symptome, auch als Folge eines veränderten Metabolismus der Dickdarmflora, bieten eine wahrscheinliche Erklärung.[24] Verschiedene probiotische, aber vor allem lebende, konventionelle Joghurtkulturen unterstützen die Milchzuckerverdauung und vermindern das Auftreten gastrointestinaler Symptome.[23]
Behandlung
[Bearbeiten | Quelltext bearbeiten]Die Auswirkungen des Lactasemangels können z. B. durch Umstellung der Ernährung auf milchzuckerarme bzw. -freie Kost auf ein Minimum reduziert werden. So gibt es Alternativen in Form verschiedener Ersatzgetränke, die teilweise auch mit zusätzlichen Vitaminen und Calcium angereichert werden. Neben Sojamilch sind Getreide- oder Mandelmilch erhältlich. Im Weiteren gibt es laktosereduzierte Milchprodukte, unter anderem Milch, aber auch Käse, Joghurt, Sahne, Quark und mehr. Eine andere Möglichkeit ist die Zufuhr des Enzyms Laktase von außen in Form von Kautabletten oder Kapseln durch entsprechende pharmazeutische Produkte aus der Drogerie oder Apotheke. Die Wirksamkeit dieser Supplemente ist jedoch nicht zweifelsfrei erwiesen.[1]
Milchzucker wird andererseits vielen Nahrungsprodukten zugesetzt, so etwa Broten, Getreideriegeln, Fertiggerichten, Würzmischungen, Wurstwaren, mariniertem Fleisch, Teigen, Bonbons, Speiseeis, Schokolade und Instantprodukten, z. B. Tütensuppen. Ein Grund dafür ist das vom Food-Designer gewünschte „Mundgefühl“, das den Geschmack positiv beeinflusst. Die meisten Betroffenen vertragen jedoch nahezu beschwerdefrei kleinere Mengen an Laktose, so dass eine völlige Meidung gar nicht notwendig ist.[26] Seit dem 25. November 2005 gelten die Vorschriften zur Kennzeichnung allergieauslösender Lebensmittelbestandteile (BGBl. I S. 2896). Die Kennzeichnungspflicht umfasst auch Milch und Milchbestandteile einschließlich der Laktose. Auch Functional Food und Medikamente, einschließlich der Antibabypille, können Laktose als Trägerstoff enthalten, jedoch in absolut unerheblicher Menge.[26]
Fermentierte Milcherzeugnisse, darunter alle Sauermilchprodukte, Käse und Quark, enthalten z. T. das Enzym Laktase von Natur aus, sodass nur sehr geringe Mengen an Milchzucker bleiben. Dies hängt vor allem mit der Herstellung zusammen. Insbesondere die in die Milch zugegebene Menge Bakterien, die mit Hilfe ihrer selbstproduzierten Laktase den Milchzucker abbauen, sowie Reifungsprozess und -dauer spielen bei Käsesorten und Joghurts dabei eine Rolle. Bei Käse gilt grundsätzlich: Je länger der Reifungsprozess, desto geringer der Laktoseanteil.
Es kommt häufig vor, dass Betroffene in der Folge Milch und Milchprodukte strikt meiden. Ob es hierbei in kritischem Maße zu einem Calciummangel kommt oder nicht, hängt von der Ausgewogenheit der sonstigen Nahrung ab. Einige Quellen berichten, dass Laktoseintolerante einem gesteigerten Osteoporose-Risiko ausgesetzt seien. Als Grund wird der geringere Verzehr von calciumhaltigen Lebensmitteln angegeben. Bei insgesamt ausgewogener Ernährung ist ein Calcium-Mangel jedoch kaum zu erwarten.
Anthropologische Befunde
[Bearbeiten | Quelltext bearbeiten]Aus einer 2007 veröffentlichten Studie des Mainzer Anthropologen Joachim Burger geht hervor, dass die Laktoseintoleranz erwachsener Menschen eine stammesgeschichtlich ursprüngliche Eigenschaft des Menschen ist, dass also die Fähigkeit, noch als Erwachsener Laktose problemlos zu verdauen, eine relativ junge genetische Neuerung ist.[27] Burger hatte gemeinsam mit britischen Kollegen neun europäische Skelette aus der Jung- und Mittelsteinzeit (7800 bis 7200 Jahre alt) untersucht und bei der Analyse ihrer Gene entdeckt, dass keines dieser Individuen in der Lage war, Milch zu verdauen. Ein zur Kontrolle analysiertes, rund 1500 Jahre altes Skelett aus der Merowingerzeit besitzt hingegen die genetische Veränderung, so dass dieses Individuum Laktose verdauen konnte. Auch eine DNS-Analyse der als Ötzi bekannt gewordenen Gletschermumie ergab, dass der vor rund 5000 Jahren verstorbene Mann laktoseintolerant war.[28]
Die Fähigkeit der Erwachsenen, Milch zu verdauen, hat sich in Europa demnach erst nach Einführung der Tierzucht, die hier seit etwa 8000 Jahren stattfindet, in der Bevölkerung verbreitet. Bei der im Jahr 2013 veröffentlichten Genomanalyse von 18 Skeletten eines mittelalterlichen Friedhofs in Dalheim[29] wiesen 13 davon (72 Prozent) den Genotyp für Lactasepersistenz auf, was dem heutigen Niveau in Deutschland und Österreich entspricht.[30][31]
2014 erschien eine Untersuchung urgeschichtlicher Bewohner der Pannonischen Tiefebene mit dem Ergebnis, dass die Europäer auch 5000 Jahre nach dem Beginn der Landwirtschaft noch keinen Milchzucker verdauen konnten.[32]
Eine im Jahr 2020 publizierte Studie kommt zu dem Ergebnis, dass sich die Lactasepersistenz erst in den zurückliegenden 3000 Jahren entwickelte.[10] 2022 kam eine Studie zu dem Ergebnis, dass in Europa seit der Jungsteinzeit zeitlich und örtlich in unterschiedlichem Ausmaß Milch konsumiert wurde. Individuen mit zunächst nicht weit verbreiteter Lactasepersistenz waren offenbar nicht allgemein gesünder oder fitter, Milch war auch nicht ihre Hauptnahrungsquelle. Vor allem während Hungersnöten und Epidemien waren Individuen mit Lactasepersistenz aber selektiv im Vorteil gegenüber nicht persistenten Individuen, da sie in solchen Notzeiten die Milch als Nahrung besser vertrugen und nicht zusätzlich von Verdauungsbeschwerden betroffen waren. Das könnte erklären, warum sich die Lactasepersistenz im zurückliegenden Zeitraum von vor 5000 bis ungefähr 3000 Jahren in Europa weiter verbreitet hatte.[33]
Verbreitung
[Bearbeiten | Quelltext bearbeiten]| Region bzw. Ethnie | Laktoseintoleranz % |
|---|---|
| Südostasien | 98 |
| China | 94 |
| Aborigines | 85 |
| Inuit (Alaska) | 80 |
| Zentralasien | 80 |
| Afroamerikaner | 79 |
| Südamerika | 65–75 |
| Sizilien | 71 |
| Südindien | 70 |
| Südfrankreich | 65 |
| Massai | 62 |
| Kreta | 56 |
| Balkan | 55 |
| Süditalien | 52 |
| Indianer | 50 |
| Norditalien | 41 |
| Nordindien | 27 |
| Beduinen | 25 |
| Tutsi (Ruanda) | 20 |
| Mittelitalien | 19 |
| Finnland | 18 |
| Nordfrankreich | 17 |
| Schweiz | 15–20 |
| Deutschland | 15 |
| Tuareg | 13 |
| Weiße in den Vereinigten Staaten | 12 |
| Österreich | 10–15 |
| Großbritannien | 5–15 |
| Dänemark | 5 |
| Schweden | 2 |
Quellen:[34][26][35][36][23][37][38][39]
Ernährungsempfehlungen zum Milchkonsum und Rassismusvorwürfe
[Bearbeiten | Quelltext bearbeiten]In den USA leben viele Menschen, die aufgrund ihrer asiatischen oder afrikanischen Abstammung laktoseintolerant sind. Gleichwohl haben die offiziellen Ernährungsempfehlungen lange dazu geraten, Milch zu konsumieren. Dass die Ernährungskommissionen die Laktoseintoleranz asiatisch- oder afrikanischstämmiger Amerikaner nicht berücksichtigt haben, hat ihnen in der Vergangenheit den Vorwurf des Rassismus eingebracht.[40]
In diesem Zusammenhang wird auch der Begriff „Laktoseintoleranz“ kritisiert, der angeblich einen weißen Standpunkt einnehme und damit diesen für viele andere Ethnien völlig normalen Zustand als abnormal definiere.[41] Anhänger der rassistischen White Supremacy Ideologie sehen in ihrer Fähigkeit Laktose zu verstoffwechseln einen Beleg für ihre vermeintliche Überlegenheit.[42][43]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Fritz Höffeler: Geschichte und Evolution der Lactose(in)toleranz. In: Biologie in unserer Zeit. Band 39, Nr. 6, 2009, S. 378–387. doi:10.1002/biuz.200910405.
- C. J. Ingram, C. A. Mulcare u. a.: Lactose digestion and the evolutionary genetics of lactase persistence. In: Human genetics. Band 124, Nummer 6, Januar 2009, S. 579–591, doi:10.1007/s00439-008-0593-6. PMID 19034520.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Laktoseintoleranz – Informationen bei Gesundheitsinformation.de (Online-Angebot des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen)
- Lactose: Vorkommen, Eigenschaften, Stoffwechsel und Diätetik – Informationen des Bayerischen Staatsministeriums für Umwelt und Verbraucherschutz
- ZEIT-Artikel: Grollen im Darm (2007)
- Andrew Curry: Die Milchrevolution - Eine einzelne Mutation hat vor langer Zeit Europäern Milch schmackhaft gemacht., bei spektrum.de, zuletzt abgerufen am 3. Mai 2018
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Stiftung für Qualität und Wirtschaftlichkeit im Gesundheitswesen: Laktoseintoleranz auf gesundheitsinformation.de, abgerufen am 24. April 2020.
- ↑ A. C. Bulhoes u. a.: Correlation between lactose absorption and the C/T-13910 and G/A-22018 mutations of the lactase-phlorizin hydrolase (LCT) gene in adult-type hypolactasia. In: Brazilian Journal of Medical and Biological Research. November 2007, abgerufen am 19. Juli 2008.
- ↑ Laktoseintoleranz - BZfE. Abgerufen am 2. März 2021.
- ↑ Oliver Rick: Klinikleitfaden Medizinische Rehabilitation. Elsevier, Urban & Fischer 2013, ISBN 978-3-437-59347-5, S. 31 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jeremy M. Berg, Lubert Stryer, John L. Tymoczko: Biochemistry. 5. Auflage. Freeman, 2002, ISBN 0-7167-4684-0, ch. 16.1.12. (englisch)
- ↑ A. Beja-Pereira, G. Luikart u. a.: Gene-culture coevolution between cattle milk protein genes and human lactase genes. In: Nature genetics. Band 35, Nummer 4, Dezember 2003, S. 311–313, doi:10.1038/ng1263. PMID 14634648. (Review).
- ↑ Jeremy M. Berg, Lubert Stryer, John L. Tymoczko: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, 2007, ISBN 978-3-8274-1800-5, S. 504.
- ↑ Yuval Itan et al.: The Origins of Lactase Persistence in Europe. In: PLoS Computational Biology. Band 5, Nr. 8, 2009, e1000491, doi:10.1371/journal.pcbi.1000491.
- ↑ Andrew Curry: Die Milch-Revolution. Auf: spektrum.de vom 12. August 2013, abgerufen am 24. April 2020.
- ↑ a b Joachim Burger et al.: Low Prevalence of Lactase Persistence in Bronze Age Europe Indicates Ongoing Strong Selection over the Last 3,000 Years. In: Current Biology. Onlineveröffentlichung vom 3. September 2020, doi:10.1016/j.cub.2020.08.033.
Milchverträglichkeit hat sich in wenigen tausend Jahren in Mitteleuropa verbreitet. Auf: idw-online.de vom 3. September 2020. - ↑ I. Jarvela, S. Torniainen, K. L. Kolho: Molecular genetics of human lactase deficiencies. In: Ann. Med. Juli 2009, S. 1–8, doi:10.1080/07853890903121033, PMID 19639477.
- ↑ O. Leiß: Diätetische Therapie bei Kohlenhydratmalabsorption und Laktoseintoleranz. In: Aktuel. Ernähr. Med. Band 30, 2006, S. 75–87.
- ↑ Thomas Löscher, Gerd-Dieter Burchard (Hrsg.): Tropenmedizin in Klinik und Praxis. 4., überarbeitete Auflage. Georg Thieme Verlag, Stuttgart 2010, ISBN 978-3-13-785804-1, S. 652 (Google Bücher).
- ↑ Alactasia. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ N. O. Berg, A. Dahlqvist u. a.: Severe familial lactose intolerance–a gastrogen disorder? In: Acta paediatrica Scandinavica. Band 58, Nummer 5, September 1969, S. 525–527, ISSN 0001-656X. PMID 5365173.
- ↑ G. Russo, F. Mollica u. a.: Congenital lactose intolerance of gastrogen origin associated with cataracts. In: Acta paediatrica Scandinavica. Band 63, Nummer 3, Mai 1974, S. 457–460, ISSN 0001-656X. PMID 4209121
- ↑ Y. Hirashima, S. Shinozuka u. a.: Lactose intolerance associated with cataracts. In: European Journal of Pediatrics. Band 130, Nummer 1, Januar 1979, S. 41–45, ISSN 0340-6199. PMID 759181.
- ↑ A. Hosková, J. Sabacký u. a.: Severe lactose intolerance with lactosuria and vomiting. In: Archives of Disease in Childhood. Band 55, Nummer 4, April 1980, S. 304–305, ISSN 1468-2044. PMID 7416780. PMC 1626838 (freier Volltext)
- ↑ M.D. Levitt: Production and excretion of hydrogen gas in man. In: The New England Journal of Medicine. 281. Jahrgang, Nr. 5, 1969, S. 122–127.
- ↑ Bedienungsanleitung des Gastrolyzer H2-Atemtestgeräts der Firma Specialmed / Bedfont (PDF; 269 kB)
- ↑ J. Futh: Molekulargenetische und klinische Untersuchungen zur Laktoseintoleranz (Hypolaktasie), Dissertation an der Medizinischen Fakultät der Universität Rostock, 2008. DNB 1000953769/34
- ↑ Irmgard Bitsch: Ernährungsempfehlungen in mittelalterlichen Quellen und ihre Beurteilung aus heutiger Sicht. In: Trude Ehlert (Hrsg.): Haushalt und Familie in Mittelalter und früher Neuzeit. Vorträge eines interdisziplinären Symposions vom 6.–9. Juni 1990 an der Rheinischen Friedrich-Wilhelms-Universität Bonn. Mit einem Register von Ralf Nelles. Thorbecke, Sigmaringen 1991, ISBN 3-7995-4156-X, S. 129–136, hier: S. 131.
- ↑ a b c d e M. de Vrese et al.: Probiotics—compensation for lactase insufficiency, in: American Journal of Clinical Nutrition Nr. 73 (suppl.) S. 421–429, 2001. doi:10.1093/ajcn/73.2.421s
- ↑ a b R. A. Forsgard: Lactose digestion in humans: intestinal lactase appears to be constitutive whereas the colonic microbiome is adaptable in: American Journal of Clinical Nutrition Nr. 110, S. 273–279, 2019. doi:10.1093/ajcn/nqz104, PMC 6669050 (freier Volltext).
- ↑ A.O. Johnson et al.: Adaptation of lactose maldigesters to continued milk intakes, in: American Journal of Clinical Nutrition Nr. 58, S. 879–881, 1993. doi:10.1093/ajcn/58.6.879
- ↑ a b c Tuula H. Vesa u. a.: Lactose Intolerance. In: Journal of the American College of Nutrition. Vol. 19, No. 90002, 2000, S. 165S–175S, PMID 10759141.
- ↑ J. Burger, M. Kirchner, B. Bramanti, W. Haak, M. G. Thomas: Absence of the lactase-persistence-associated allele in early Neolithic Europeans. In: PNAS. Band 104, Nr. 10, vom 6 März 2007, S. 3736–3741, doi:10.1073/pnas.0607187104.
- ↑ Andreas Keller u. a.: New insights into the Tyrolean Iceman’s origin and phenotype as inferred by whole-genome sequencing. In: Nature Communications. Band 3, Artikel-Nr. 698, 2012, doi:10.1038/ncomms1701
- ↑ M. I. Hofmann, T. Böni, K. W. Alt, U. Woitek, F. J. Rühli: Paleopathologies of the vertebral column in medieval skeletons. In: Anthropologischer Anzeiger; Bericht über die biologisch-anthropologische Literatur. Band 66, Nummer 1, März 2008, S. 1–17, PMID 18435203.
- ↑ Europäer waren vor 1.000 Jahren laktosetolerant. auf: derstandard.at, 29. Januar 2014, abgerufen am 29. Januar 2014.
- ↑ Annina Krüttli, Abigail Bouwman u. a.: Ancient DNA Analysis Reveals High Frequency of European Lactase Persistence Allele (T-13910) in Medieval Central Europe. In: PLoS ONE. 9, 2014, S. e86251, doi:10.1371/journal.pone.0086251.
- ↑ nature.com, publ. 21. Oktober 2014: Genome flux and stasis in a five millennium transect of European prehistory.
- ↑ Richard P. Evershed, George Davey Smith, Mélanie Roffet-Salque, Adrian Timpson, Yoan Diekmann: Dairying, diseases and the evolution of lactase persistence in Europe. In: Nature. 27. Juli 2022, ISSN 1476-4687, S. 1–10, doi:10.1038/s41586-022-05010-7 (nature.com [abgerufen am 28. Juli 2022]).
Hungersnöte und Krankheitserreger trieben die Verbreitung der Laktosetoleranz in Europa voran. Auf: idw-online.de vom 27. Juli 2022. - ↑ The Molecular Explanation. Information – Concepts In Nutrigenomics – Lactose Intolerance, 2012, The NCMHD Center of Excellence for Nutritional Genomics
- ↑ Lactose Intolerance. In: Kenneth F. Kiple (Hrsg.): The Cambridge World History of Food. Cambridge 2000, S. 1060.
- ↑ Norman Kretchmer: Lactose and Lactase. In: Scientific American. Oct. 1972 Oct; 227(4), S. 71–78.
- ↑ R. T. Jackson u. a.: Lactose malabsorption among Masai children of East Africa. In: American Journal of Clinical Nutrition. 1979, Vol. 32, S. 779–782.
- ↑ Laktoseintoleranz. Österreichische Gesellschaft für Ernährung, abgerufen am 17. April 2017.
- ↑ Keller et al.: Sechster Schweizerischer Ernährungsbericht. Bundesamt für Gesundheit, Bern 2012. Seite 163 (online)
- ↑ P. Bertron, N. D. Barnard, M. Mills: Racial bias in federal nutrition policy, Part I: The public health implications of variations in lactase persistence. In: Journal of the National Medical Association. Band 91, Nr. 3, März 1999, ISSN 0027-9684, S. 151–157, PMID 10203917, PMC 2608451 (freier Volltext).
- ↑ Andrea Freeman: The Unbearable Whiteness of Milk: Food Oppression and the USDA. S. 1262 (uci.edu [PDF]).
- ↑ Emily Moon: Why Is Milk Being Called a White Supremacist Symbol? Abgerufen am 16. November 2021 (englisch).
- ↑ Amy Harmon: Why White Supremacists Are Chugging Milk (and Why Geneticists Are Alarmed). In: The New York Times. 17. Oktober 2018, ISSN 0362-4331 (nytimes.com [abgerufen am 16. November 2021]).