Menthol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Menthol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C10H20O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, glänzende Prismen[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 156,27 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
0,89 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt |
31, 33, 35 und 42,5–43 °C [(−)-Menthol, 4 Modifikationen][1] | |||||||||||||||||||||
| Siedepunkt |
212 °C[2] | |||||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser, gut löslich in Ethanol, Diethylether und Chloroform[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Menthol ist ein monocyclischer Monoterpen-Alkohol. Es existiert in zwei spiegelbildlichen Formen, dem (−)-Menthol (Levomenthol) und dem (+)-Menthol. Neben Menthol existieren drei weitere Diastereomerenpaare (auch „isomere Menthole“ genannt), da die Verbindung drei asymmetrische C-Atome besitzt: das Neomenthol, Isomenthol und Neoisomenthol.
Das natürliche, linksdrehende (−)-Menthol kommt in vielen ätherischen Ölen, besonders in Minzölen, vor.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Aus Ackerminze (Mentha arvensis L.) wird in Japan seit dem 17. Jahrhundert Pfefferminzöl gewonnen. Dieses enthält (−)-Menthol als Hauptbestandteil.[3]
Von den Isomeren kommt (−)-Menthol in der Natur am häufigsten vor.[4] Man findet es im ätherischen Öl von Pflanzen der Gattung Mentha; im „Japanischen Pfefferminzöl“ aus in Japan oder China angebauter Ackerminze (Mentha arvensis) sind bis zu 90 % enthalten.[1] Auch im Öl der Pfefferminze (Mentha piperita) ist (−)-Menthol die Hauptkomponente.[4] Menthole finden sich auch in anderen Gattungen und Arten der Familie der Lippenblütler (Labiatae), so in der Krause Minze,[5] dem Arabischen Bergkraut (Micromeria fruticosa),[6] und den Gewürzpflanzen Estragon (Artemisia dracunculus), Basilikum (Ocimum basilicum), Majoran (Origanum majorana), Oregano (Origanum vulgare), Rosmarin (Rosmarinus officinalis), Salbei (Salvia) und Thymianen (Thymus),[7][6] aber auch in Bittermelonen (Momordica charantia),[8] und Sonnenblumen (Helianthus annuus)[6]. (+)-Menthol kommt vor allem in der Polei-Minze (Mentha pulegium, bis ca. 16 % im ätherischen Öl) vor.[9] (+)-Neomenthol findet sich im japanischen Pfefferminzöl, (−)-Neoisomenthol mit bis zu einem Prozent im Geraniumöl.
-
Ackerminze
-
Pfefferminze
-
Estragon
-
Basilikum
-
Majoran
-
Oregano
-
Rosmarin
-
Salbei
-
Thymian
-
Polei-Minze
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Jährlich werden weltweit über 19.000 Tonnen (−)-Menthol hergestellt,[1] wobei etwa zwei Drittel aus Pflanzen gewonnen und ein Drittel synthetisch hergestellt werden.[10] Die pflanzliche Gewinnung erfolgt durch Ausfrieren des kristallinen Menthols aus dem ätherischen Öl der Ackerminze. Die technische Synthese des (−)-Menthols erfolgt aktuell nach verschiedenen Verfahren bei den Firmen Symrise (vormals Haarmann & Reimer, ab 1973), Takasago (ab 1984) und BASF (ab 2012).[11]

Das Bild zeigt eine technische Synthese des (−)-Menthols. Sie geht vom Citronellal (1) aus, dem Zinkbromid zugefügt wird. In einer Carbonyl-En-Reaktion wird es zum Isopulegol (2) umgewandelt. Dieses wird an Nickelkatalysatoren zum Menthol (3) hydriert. Dies ist aber nur eine von vielen Menthol-Synthesen: Menthol lässt sich auch ausgehend vom Pulegon, Phellandren, 3-Caren, Pinen, Limonen, Myrcen, Piperiton oder durch Hydrierung vom Thymol beziehungsweise dem Kresol synthetisieren.
Eigenschaften und Isomerie
[Bearbeiten | Quelltext bearbeiten]
Bei Raumtemperatur ist Menthol ein farbloser, kristalliner Feststoff mit Pfefferminzgeruch. Die Symmetrie des Kristallgitters ist trigonal,[12] die Kristalle sind nadelförmig.
2-Isopropyl-5-methylcyclohexanol besitzt drei stereogene Zentren, deshalb gibt es acht Stereoisomere:
| Isomere von Menthol | ||||||||
|---|---|---|---|---|---|---|---|---|
| Name | (+)-Menthol | (−)-Menthol | (+)-Isomenthol | (−)-Isomenthol | (+)-Neomenthol | (−)-Neomenthol | (+)-Neoisomenthol | (−)-Neoisomenthol |
| Andere Namen | D-Menthol | Levomenthol,
L-Menthol |
D-Isomenthol | L-Isomenthol | D-Neomenthol | L-Neomenthol | D-Neoisomenthol | L-Neoisomenthol |
| (±)-Menthol, DL-Menthol, Racementhol
[DL-(±)-Gemisch] |
DL-Isomenthol [DL-(±)-Gemisch] | DL-Neomenthol [DL-(±)-Gemisch] | DL-Neoisomenthol [DL-(±)-Gemisch] | |||||
| Strukturformel | 
|

|

|

|

|

|

|

|
| Stereozentren | 1S,2R,5S | 1R,2S,5R | 1S,2R,5R | 1R,2S,5S | 1S,2S,5R | 1R,2R,5S | 1R,2R,5R | 1S,2S,5S |
| Schmelzpunkt | 31, 33, 35 und 42,5–43 °C
(4 Modifikationen)[1] |
82,5 °C[13] | ? | −8 °C[14] | ||||
| ? | 53,5–54,5 °C[13][DL-(±)-Gemisch] | 50–51 °C[15] [DL-(±)-Gemisch] | 14 °C[14][DL-(±)-Gemisch] | |||||
| Siedepunkt | 212 °C[16] | 96,2–96,8 °C(10 mmHg)[13] | 102 °C(19 mmHg)[17] | 105 °C(12 mmHg)[17] | ||||
| ? | 218,5–218,6 °C[13][DL-(±)-Gemisch] | 212,1–212,6 °C[15][DL-(±)-Gemisch] | 81 °C(6 mmHg)[14][DL-(±)-Gemisch] | |||||
| Drehwert | 49,6°(Ethanol)[14] | 25,9°(Ethanol)[14] | 20,7°(Ethanol)[14] | 2,2°(Ethanol)[14] | ||||
| CAS-Nummer | 15356-60-2 | 2216-51-5 | 23283-97-8 | 20752-33-4 | 2216-52-6 | 20747-49-3 | 20752-34-5 | 64282-88-8 |
| 89-78-1 [DL-(±)-Gemisch] | 3623-52-7 [DL-(±)-Gemisch] | 3623-51-6 [DL-(±)-Gemisch] | 491-02-1 [DL-(±)-Gemisch] | |||||
Alle sind sekundäre, einwertige Alkohole: Das Molekül weist eine Hydroxygruppe auf; an das Kohlenstoffatom, an welches diese Hydroxygruppe gebunden ist, sind direkt nur zwei weitere Kohlenstoffatome gebunden. Der internationale Freiname (INN) des aus (−)-Menthol und (+)-Menthol im Enantiomerenverhältnis von 1:1 bestehenden Stoffes ist Racementhol.
Die Geschmacksschwelle liegt zwischen 0,2 ppm für (−)-Menthol und 1 ppm für (+)-Menthol.
Die Stereoisomere unterscheiden sich unter anderem im Geruch:
- (+)- und (−)-Menthol riechen frisch, minzig und süß und machen den typischen Pfefferminzgeruch aus, wobei der Geruch beim (−)-Menthol circa dreimal stärker ausgeprägt ist.[18]
- (−)-Neoisomenthol riecht nach Campher, schal, süß, minzig; (+)-Neoisomenthol hat einen Geruch nach Campher, schal und nach Wald, es riecht hingegen nicht minzig, kühl und frisch.
Isomenthol, Neomenthol und Neoisomenthol weisen auch keinen – beim Einatmen im Mund subjektiv gefühlten – Kühleffekt auf.[18]
Reaktionsfähigkeit
[Bearbeiten | Quelltext bearbeiten]Die Oxidation von Menthol [im Bild (−)-Menthol] mit Chromsäure liefert Menthon [im Bild (−)-Menthon]:[20]
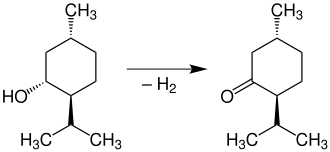
Durch Einwirkung von konzentrierter Schwefelsäure wird Menthol [im Bild (−)-Menthol] zu Menthen dehydratisiert:

Verwendung
[Bearbeiten | Quelltext bearbeiten]Menthol wird in verschiedensten Produkten als desinfizierender Bestandteil sowie als Duft- und Aromastoff zugesetzt, so etwa in Süßwaren (0,05–0,1 %) und Likör (0,1–0,2 %), Parfüm (0,05–0,4 %), Körperpflege-, Zahn- und Mundpflegemitteln (0,5–2,0 %), Lotionen (0,2–0,3 %) und Haarwässern (0,2–0,5 %).[1]
Medizinisch ist Menthol Bestandteil von Salben (bis zu 6 %) und Einreibemitteln gegen Hautirritationen bei leichten Verbrennungen, Insektenstichen oder Juckreiz.[1] Es wirkt am Kälte-Menthol-Rezeptor (TRPM8).[21] Daher erzeugt Menthol ein kühles Gefühl beim Auftragen auf die Haut, ohne jedoch tatsächlich die Körpertemperatur zu beeinflussen. Bei Reizung nasaler Kälterezeptoren[18] entsteht das Gefühl einer erleichterten Atmung.
Menthol blockiert die spannungsabhängigen Natriumkanäle Nav1.8 und NAv1.9. Dadurch wirkt Menthol lokalanästhetisch.
Durch die Aktivierung des GABAA -Rezeptors ist die zentral dämpfende Wirkung zu erklären.
Außerdem wirkt Menthol als schwacher Agonist am κ-Opioid-Rezeptor (KOR).[22]
In der Bienenpflege dient Menthol als Mittel gegen Milbenbefall.
Tabakprodukte
[Bearbeiten | Quelltext bearbeiten]Tabakprodukten wird Menthol seit den 1920er Jahren zugesetzt. Es vermindert beim Inhalieren des Rauches das Reiz- und Schmerzempfinden im Atemtrakt. Es verändert die Dichte von Nikotinrezeptoren im Zentralnervensystem.[23] Zusätzlich verändert es den Metabolismus von Nikotin und erhöht dessen Bioverfügbarkeit. Es verstärkt die Nikotinsucht.[24][25][26][27] EU-weit ist das Inverkehrbringen von Tabakerzeugnissen mit Mentholzusatz seit dem 20. Mai 2020 verboten;[28] Hülsen mit Menthol-Aroma sind weiterhin erlaubt.
Gefahrenhinweise
[Bearbeiten | Quelltext bearbeiten]Menthol ist reizend; schon wenige Gramm Menthol verursachen Herzrhythmusstörungen. Zusätzliche Gefahr besteht für Säuglinge und Kleinkinder, da bei ihnen durch Inhalation von Menthol eine schwere Atemnot mit Atemstillstand auftreten kann. Die mittlere letale Dosis (LD50) von (−)-Menthol bei oraler Aufnahme für eine Ratte liegt bei 3300 mg/kg.[29]
Verstoffwechselung
[Bearbeiten | Quelltext bearbeiten]Die Verstoffwechselung des Menthols erfolgt hauptsächlich in der Leber durch Bildung von Mentholglucuronid, welches über den Harn ausgeschieden wird.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Friedrich Hartmut Dost: Menthol and menthol-containing external remedies. Thieme-Verlag, Stuttgart 1967, DNB 457573562.
- Anja Langeneckert: Untersuchungen zur Pharmakokinetik und relativen Bioverfügbarkeit von α-Pinen, 1,8-Cineol und Menthol nach dermaler, inhalativer und peroraler Applikation ätherischer Öle. Shaker Verlag, 1999, ISBN 3-8265-6457-X.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Riechstofflexikon auf www.chemikalienlexikon.de: Menthol/Levomenthol, abgerufen am 9. Juni 2013
- Leffingwell & Associates: Menthol – A Cool Place, abgerufen am 9. Juni 2013
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu Menthol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. August 2013.
- ↑ a b c d Eintrag zu Menthol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Bernd Schäfer: Naturstoffe in der chemischen Industrie. Spektrum Akademischer Verlag, 2007, ISBN 978-3-8274-1614-8, S. 96–104.
- ↑ a b Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann’s Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 73–198, doi:10.1002/14356007.a11_141 (englisch).
- ↑ Massimo Maffei, Arnaldo Codignola, Maurizio Fieschi: Essential oil from Mentha spicata L. (spearmint) cultivated in Italy. In: Flavour and Fragrance Journal. Band 1, Nr. 3, Juni 1986, S. 105–109, doi:10.1002/ffj.2730010303 (englisch).
- ↑ a b c MENTHOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. Juli 2021.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Menthol im Lexikon der Ernährung, abgerufen am 26. August 2013.
- ↑ (−)-MENTHOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. Juli 2021.
- ↑ (+)-MENTHOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. Juli 2021.
- ↑ Menthol Background & Menthol Enantiomers - Organoleptic Properties. Leffingwell & Associates, abgerufen am 26. August 2013.
- ↑ B. Schäfer, Chemie in unserer Zeit, 2013, 47, 174; doi:10.1002/ciuz.201300599.
- ↑ R. Bombicz, J. Bushmann, P. Luger, Nguyen Xuan Dung, Chu Ba Nam: Crystal structure of (1R,2S,5R)-2-isopropyl-5-methyl-cyclohexanol, (−)-menthol. In: Z. Kristallogr. 214, Heft 7, 1999, S. 420–423.
- ↑ a b c d John Read, William J. Grubb, David Malcolm: 51. Researches in the menthone series. Part XI. Diagnosis and characterisation of the stereoisomeric menthols. In: Journal of the Chemical Society (Resumed). 1933, S. 170, doi:10.1039/jr9330000170.
- ↑ a b c d e f g John Read, William J. Grubb: 76. Researches in the menthone series. Part XII. Isolation and characterisation of the neoisomenthols. In: Journal of the Chemical Society (Resumed). 1934, S. 313, doi:10.1039/jr9340000313.
- ↑ a b John Read, William J. Grubb: 50. Researches in the menthone series. Part X. The complete optical resolution of dl-neomenthol by means of 1-menthol. In: Journal of the Chemical Society (Resumed). 1933, S. 167, doi:10.1039/jr9330000167.
- ↑ Bruno Puetzer, William J. Moran: Separation of l-menthol from racemic menthol U. S. P.*. In: Journal of the American Pharmaceutical Association (Scientific ed.). Band 35, Nr. 4, April 1946, S. 127–128, doi:10.1002/jps.3030350407.
- ↑ a b Waichiro Tagaki, Takeshi Hashizume: Notes - Synthesis and Properties of Isomeric Menthyl Phosphates. Organophosphorus Compounds III. In: The Journal of Organic Chemistry. Band 26, Nr. 8, August 1961, S. 3038–3040, doi:10.1021/jo01066a644.
- ↑ a b c d K. Hardtke u. a. (Hrsg.): Kommentar zum Europäischen Arzneibuch Ph. Eur. 4.0, Menthol. Loseblattsammlung, 20. Lieferung 2005, Wissenschaftliche Verlagsgesellschaft Stuttgart.
- ↑ H. Wagner: Pharmazeutische Biologie. 2. Auflage. WVG, 1981, S. 48.
- ↑ H. C. Brown, C. P. Garg: A simple procedure for the chromic acid oxidation of alcohols to ketones of high purity. In: J. Am. Chem. Soc. 83, 1961, S. 2952–2953. doi:10.1021/ja01474a037
- ↑ Diana M. Bautista, Jan Siemens, Joshua M. Glazer, Pamela R. Tsuruda, Allan I. Basbaum, Cheryl L. Stucky, Sven-Eric Jordt, David Julius: The menthol receptor TRPM8 is the principal detector of environmental cold. In: Nature. Band 448, Nr. 7150, Juli 2007, S. 204–208, doi:10.1038/nature05910.
- ↑ Andreas Bechthold, Robert Fürst, Angelika Vollmar: Biogene Arzneistoffe. 1. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2019, ISBN 978-3-8047-3623-8, S. 201–202.
- ↑ B. J. Henderson et al.: Menthol Alone Upregulates Midbrain nAChRs, Alters nAChR Subtype Stoichiometry, Alters Dopamine Neuron Firing Frequency, and Prevents Nicotine Reward. In: The Journal of neuroscience : the official journal of the Society for Neuroscience. Band 36, Nummer 10, März 2016, S. 2957–2974, doi:10.1523/JNEUROSCI.4194-15.2016, PMID 26961950, PMC 4783498 (freier Volltext).
- ↑ K. Ahijevych, B. E. Garrett: The role of menthol in cigarettes as a reinforcer of smoking behavior. In: Nicotine & tobacco research : official journal of the Society for Research on Nicotine and Tobacco. Band 12 Suppl 2, Dezember 2010, S. S110–S116, doi:10.1093/ntr/ntq203, PMID 21177367, PMC 3636955 (freier Volltext) (Review).
- ↑ R. J. Wickham: How Menthol Alters Tobacco-Smoking Behavior: A Biological Perspective. In: The Yale journal of biology and medicine. Band 88, Nummer 3, September 2015, S. 279–287, PMID 26339211, PMC 4553648 (freier Volltext) (Review).
- ↑ L. Biswas, E. Harrison, Y. Gong, R. Avusula, J. Lee, M. Zhang, T. Rousselle, J. Lage, X. Liu: Enhancing effect of menthol on nicotine self-administration in rats. In: Psychopharmacology. Band 233, Nummer 18, September 2016, S. 3417–3427, doi:10.1007/s00213-016-4391-x, PMID 27473365, PMC 4990499 (freier Volltext).
- ↑ T. Wang, B. Wang, H. Chen: Menthol facilitates the intravenous self-administration of nicotine in rats. In: Frontiers in behavioral neuroscience. Band 8, 2014, S. 437, doi:10.3389/fnbeh.2014.00437, PMID 25566005, PMC 4267270 (freier Volltext).
- ↑ Anlage 1, in Verb. mit § 4 Tabakerzeugnisverordnung (TabakerzV) vom 27. April 2016.
- ↑ FAO Nutrition Meetings Report Series. Vol. 44A, 1967, S. 58.










