Lignin
| Strukturformel | |||
|---|---|---|---|
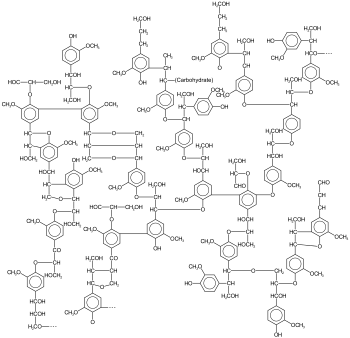 Beispiel einer Ligninstruktur | |||
| Allgemeines | |||
| Name | Lignin | ||
| CAS-Nummer | 9005-53-2 | ||
| Monomere/Teilstrukturen | Cumarylalkohol, Coniferylalkohol, Sinapylalkohol | ||
| Art des Polymers | |||
| Kurzbeschreibung |
cremefarbener Feststoff[1] | ||
| Eigenschaften | |||
| Aggregatzustand |
fest | ||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Lignine (lateinisch lignum ‚Holz‘) bilden eine Gruppe von phenolischen Makromolekülen (Biopolymeren), die sich aus verschiedenen Monomerbausteinen zusammensetzen. Es sind feste Biopolymere, die in die pflanzliche Zellwand eingelagert werden; dadurch bewirken sie die Verholzung der Zelle (Lignifizierung). Etwa 20 bis 30 Prozent der Trockenmasse verholzter Pflanzen (= der Holzzellwandsubstanz) bestehen aus Ligninen, damit sind sie neben der Cellulose und dem Chitin die häufigsten organischen Verbindungen der Erde. Die Gesamtproduktion der Lignine wird auf etwa 20 Milliarden Tonnen pro Jahr geschätzt.[3]

Lignine sind wesentlich für die Druckfestigkeit und Beständigkeit pflanzlicher Gewebe, so ist die Evolution der landlebenden Pflanzen und vor allem der Bäume sehr eng mit der Bildung von Lignin verknüpft. Nur mit Lignin können Pflanzen Festigungselemente ausbilden, welche die Stabilität größerer Pflanzenkörper außerhalb des Wassers gewährleisten. Im Wasser sorgt die im Verhältnis geringe Dichte für den statischen Auftrieb.[4]
Funktion
[Bearbeiten | Quelltext bearbeiten]
Lignin hat als Stützmaterial und verhärtetes Polymer eine Reihe wichtiger Aufgaben für die Pflanze. Lignine sind wesentlich für die Festigkeit pflanzlicher Gewebe, vor allem für ihre Druckfestigkeit, während die eingelagerten Cellulosefasern die Zugfestigkeit gewährleisten. Reißfeste, biegsame Fasern (Cellulose) werden also von einem dichten und starren Polymer als Füllmaterial (Lignin) durchdrungen.[5] Als Analogien sind technische Materialien wie Stahlbeton oder naturfaserverstärkter Kunststoff entsprechend aufgebaut.
Pflanzen ohne Lignin können durch die Cellulose zwar beträchtlichen Zugkräften standhalten, gegenüber Druck sind sie dagegen empfindlich. Ohne Lignin können keine Festigungselemente ausgebildet werden, die bei fehlendem Auftrieb durch das Wasser die Stabilität größerer Pflanzenkörper gewährleisten und entsprechende Tragestrukturen entgegen der Druckwirkung durch die Gewichtskraft aufbauen. Die Ausbildung von Verzweigungen und Astsystemen zur Schaffung großer photosynthetisch wirksamer Flächen kann nur durch eine Stabilisierung der Äste erfolgen.[6]
Außerdem dient Lignin als Kittmaterial für den Zellverbund über die Mittellamelle. Es bietet Schutz gegen Eindringen von Wasser in das Zellwandmaterial und hält dieses somit in den Leitgefäßen (Xylem und Phloem) sowie im Innern der Zellen. Weitere Schutzwirkung besteht gegenüber UV-Licht sowie mechanischer Beschädigung und dem Eindringen von Schädlingen. Schließlich kann Lignin nur schwer von Bakterien bzw. Pilzen abgebaut werden und hemmt infolgedessen das Wachstum pathogener Mikroorganismen passiv[7] sowie aktiv durch den Aufbau von Wundlignin in Bereichen mit mechanischer Beschädigung.[6] Eine ähnliche Struktur mit einem analogen Aufbau stellt das Suberin dar, das vor allem in den Zellwänden des Phellems (Kork) vorkommt.
Die Evolution der landlebenden Pflanzen und vor allem der Bäume ist eng mit der Ligninbiosynthese verknüpft: Das Lignin ist erst mit dem Auftreten dieser Pflanzen als echtes Lignin anzutreffen, während in ursprünglicheren Pflanzen wie Grünalgen nur die Bausteine oder lignin-ähnliche Polymere vorhanden sind.[8] Die aktuelle Annahme ist, dass Lignin eine Neuentwicklung und damit ein gruppenbegründendes Merkmal (Autapomorphie) der Gefäßpflanzen darstellt.[9] Wahrscheinlich konnte es sich zuerst als Abwehrstoff gegenüber Pilzinfektionen in Form von Wundlignin etablieren und nahm darauf aufbauend die zentrale Funktion als Stabilisationsmaterial ein.[6] 2009 konnte allerdings auch in Rotalgen der Art Calliarthron cheilosporioides Lignin nachgewiesen werden.[10] Dies wirft die Frage auf, ob es entweder konvergent sowohl bei den höheren Pflanzen als auch bei den Rotalgen entstanden ist, oder vielleicht bereits früh in der Entwicklung der Eukaryoten auftauchte und bei anderen Organismen wieder verschwunden ist.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Lignin ist sehr fest bis spröde und hell- bis dunkelbraun gefärbt. Es ist optisch isotrop, UV-Licht wird von dem Material fast vollständig absorbiert, sichtbares Licht zum Teil.
Allerdings ist Lignin keine einheitliche Substanz, sondern eine Gruppe phenolischer Makromoleküle, die sich aus verschiedenen Monomerbausteinen zusammensetzen. Dabei wird durch die Kombination ähnlicher Grundmoleküle eine dicht vernetzte, amorphe Masse aufgebaut. Die Struktur besitzt im Vergleich zu Polysacchariden wesentlich weniger polare Gruppen, wodurch Lignine hydrophob und damit in Wasser und vielen anderen Lösungsmitteln nicht löslich sind. Aus diesem Grund sind sie biologisch wie chemisch schwerer abbaubar als andere natürliche Stoffe.
Struktur und Zusammensetzung des Lignins
[Bearbeiten | Quelltext bearbeiten]Lignine sind dreidimensionale und amorphe Netzwerke (Polymere) aus aromatischen Grundbausteinen, die in vielfältiger Form miteinander verknüpft sind. Neben aromatischen Bindungen enthalten sie viele weitere Kohlenstoff-Kohlenstoff-Einfach- und Doppelbindungen, zudem kommen viele phenolische Gruppen vor.
Es sind höhermolekulare (relative Molekülmasse etwa 5000–10000) Abkömmlinge der Phenylpropanoide, die als Substituenten des Benzolrings neben einer Propankette eine OH- bzw. Hydroxygruppe, ein oder zwei OCH3- bzw. Methoxy- sowie verschiedene Restketten (Alkoxy- oder Aryloxy-Gruppen) enthalten.[11] Da die Makromoleküle allerdings in alle Raumrichtungen wachsen, wobei besonders die Mittellamellen eine starke Ausdehnung ermöglichen und auch sekundär miteinander verkettet sind, entspricht die Ligninmasse bei einem ausgewachsenen Baum zuletzt wahrscheinlich einem einzigen Lignin-Polymermolekül, dessen Masse dann mehrere Tonnen beträgt.[5]
Abhängig von der Holzart setzt es sich aus Strukturen zusammen, welche auf die Basisbausteine p-Cumarylalkohol, Coniferylalkohol und Sinapylalkohol (Monolignole) zurückzuführen sind (siehe Biosynthese). Da das Lignin in einem radikalischen Prozess entsteht, bei dem die Radikalbildung enzymatisch erfolgt, aber nicht deren Weiterreaktion, sind die Zusammensetzung und die Anteile der einzelnen Bausteine stark variabel; eine gerichtete Verknüpfung nach einem immer gleichen Schema existiert nicht.[3] Neben der Variabilität jedes einzelnen Ligninmoleküls unterscheidet sich zudem das Lignin verschiedener Holz- bzw. Pflanzenarten durch die Anteile der Alkohole bzw. der davon abgeleiteten Phenylreste: Nadelholz-Lignin enthält überwiegend Coniferyl-Einheiten (etwa 90 Prozent), die einen Guajacylrest (3-Methoxy-4-hydroxy-phenylrest) besitzen und daher als G-Lignin bezeichnet wird. Laubholzlignin enthält wechselnde Anteile von Guajacylresten und Sinapyl-Elemente, die einen Syringylrest (3,5-Methoxy-4-hydroxy-phenylrest) enthalten. Der Syringylanteil kann zwischen 5 und 65 Prozent betragen, die resultierenden Lignine werden als GS-Lignin bezeichnet. Das Lignin der teilweise verholzten Gräser und anderer Einkeimblättriger zeichnet sich durch einen hohen Anteil von etwa 15 bis 35 Prozent Cumaryl-Elementen aus, die das para-Hydroxy-Phenylpropan bilden und gemeinsam mit einem Syringylanteil in gleicher Höhe und einem Guajacylanteil von 50 bis 70 Prozent die HGS-Lignine bilden.[11] In geringen Mengen werden zudem Zimtsäuren und Zimtaldehyde (die Ausgangsstoffe der Basis-Alkohole) in die Matrix integriert.[12]
In der Analytik sind verschiedene Nachweisreaktionen für Lignin bekannt, die auf dem Aufbau des Stoffes beruhen. Zur Feststellung der Anwesenheit von Lignin kommt es zu einer Rotfärbung durch salzsaure Phloroglucinlösung. Diese Reaktion geht auf die in die Ligninmatrix eingebetteten Zimtaldehyde zurück.[12] Durch die unterschiedliche Zusammensetzung der Lignine in Nadelhölzern und Laubhölzern kann durch die unterschiedliche Färbung, die mit diesem Nachweis erreicht wird, zwischen den beiden Holztypen unterschieden werden. Nadelhölzer färben sich hierbei kirschrot, Laubhölzer rotviolett. Außerdem ist eine Gelbfärbung mit Anilin/Schwefelsäure und eine Violettfärbung mit Schiffschem Reagenz möglich. Zur qualitativen Analyse wird vor allem die Gaschromatographie eingesetzt. Der Lignin-Anteil wird mit dem Klason-Verfahren bestimmt, bei dem die Polysaccharide durch eine zweistufige Säurehydrolyse abgebaut und der verbleibende Ligninrest anschließend gewogen wird (Klasen-Lignin). Bei GS-Ligninen ist anschließend eine UV-Spektroskopie der Säurelösung notwendig, da diese säurelösliche Anteile des Lignins enthält.[11]
Ligninanteile
[Bearbeiten | Quelltext bearbeiten]| Hexosen (Cellulose) |
Pentosen (Hemicellulosen) |
Lignine | |
|---|---|---|---|
| Nadelholz | 57–60 | 7–11 | 27–32 |
| Birkenholz | 45–47 | 21–27 | 19–20 |
| Buchenholz | 50–54 | 19–24 | 22–23 |
| Weizenstroh | 35–39 | 22–24 | 18–25 |
| Maisspindeln | 37–44 | 32–35 | 15–19 |
| Bagasse | 42–50 | 29–42 | 16–21[14] |
Die nebenstehende Tabelle stellt die Anteile von Lignin, Cellulose und Hemicellulosen bei verschiedenen Biomasserohstoffen dar. Dabei handelt es sich vor allem um kommerziell relevante Hölzer und lignocellulosehaltige Reststoffe.
Lignin als Zellwandverstärkung
[Bearbeiten | Quelltext bearbeiten]Pflanzliche Zellwände bestehen aus Cellulosefibrillen, die in eine Matrix aus Pektinen, Hemicellulosen, Proteinen und Lignin eingebunden sind. Dabei lagern sich die Cellulosemoleküle aus jeweils etwa 80 Einzelmolekülen parallel zu so genannten Elementarfibrillen bzw. Micellarsträngen zusammen, die durch Wasserstoffbrücken stabilisiert werden. Jeweils 20 dieser Micellarstränge bilden gemeinsam eine Mikrofibrille mit einem Durchmesser von etwa 20 bis 30 Nanometer. Die Mikrofibrillen wiederum können sich zu Makrofibrillen mit einem Durchmesser von etwa 400 Nanometern zusammenlegen, dabei entstehen Zwischenräume von etwa 10 Nanometern, die als interfibrilläre Räume bestehen bleiben. Die interfibrillären Räume dienen unter anderem dem Wassertransport in der Zellwand, außerdem werden in diese Zwischenräume größere Moleküle wie Hemicellulosen, Pektine und Lignin zur Festigung der Cellulosestruktur eingelagert (Inkrustierung).[15]
Bei den meisten pflanzlichen Geweben beträgt der Ligninanteil nur etwa 1 Prozent, bei aufgrund von Druckbelastungen verholzten Pflanzenteilen kann er über 30 Prozent der Gesamtmasse betragen; man spricht in diesen Fällen von Lignocellulose. Neben Lignin können verschiedene mineralische Substanzen für die Inkrustierung zuständig sein, darunter etwa Silikate bei Gräsern, Riedgräsern und Schachtelhalmen oder Calciumcarbonat bei Kalkalgen.[5]
Bei einer Verholzung wird die ursprüngliche Zellwandmatrix durch das Ligninpolymer mit den eingelagerten Cellulosefasern ersetzt. Die Cellulosefasern sind dabei so dicht in das Polymer eingepackt, dass sie sich nicht mehr gegeneinander verschieben können und ihre Quellfähigkeit verlieren.[5] Eine besondere Form der Verholzung findet im sogenannten Reaktionsholz statt: Holzbereiche, die besonders starken Belastungen ausgesetzt sind, verstärken sich kontinuierlich. Diese Reaktion fällt allerdings unterschiedlich aus; bei waagerecht wachsenden Ästen der Nadelbäume kommt es beispielsweise aufgrund der Druckbelastung verstärkt zu einer Verholzung der Astunterseite durch ligninreiches Druckholz. Laubbäume hingegen verstärken bei der gleichen Beanspruchung vor allem die Astoberseite mit cellulosereichem Zugholz ohne Liginanteile.[5]
Xylemverholzung
[Bearbeiten | Quelltext bearbeiten]
Druckbeanspruchung entsteht nicht nur bei Konstruktionselementen, sondern auch in den Bereichen der Pflanze, die einem hohen Innendruck standhalten müssen. Dies ist vor allem in den Leitbahnen für den Wassertransport im Stamm und in den Wurzeln gegeben, da hier das Wasser entgegen der Schwerkraft transportiert wird und auf die umliegenden Gewebe drückt. Entsprechend bilden sich hier Verholzungen, die zu Zellwandröhren mit hohem Ligninanteil führen. Der wasserabweisende (hydrophobe) Charakter ist bei dieser Funktion eine wesentliche Eigenschaft, da er ein Austreten des Wassers aus den Leitbahnen in das umgebende Zellgewebe verhindert und somit den Wassertransport über weite Strecken zulässt.
Diese wasserleitenden Elemente des Xylems, die aufgrund ihrer Größe und ihres Aufbaus in Tracheen und Tracheiden unterschieden werden, können bei Landpflanzen gemeinsam mit dem xylemverstärkenden Sklerenchym zu den wichtigsten tragenden Strukturen gezählt werden.[5]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Biosynthese der Ligninvorstufen
[Bearbeiten | Quelltext bearbeiten]
Das Lignin ist ein Abkömmling der Phenylpropanoide, die sich selbst wiederum vom L-Phenylalanin ableiten. Durch Abspaltung von Ammoniak durch eine Phenylalanin-Ammoniak-Lyase (PAL) (EC 4.3.1.5) entsteht aus dem Phenylalanin eine Zimtsäure. Diese wird durch weitere Enzyme zu p-Coumaryl-Coenzym A umgesetzt. Diese Verbindung ist das Ausgangsprodukt für weitere Modifikationen, beispielsweise Hydroxylierungen am Aromatenring und nachfolgenden Methylierungen.[16] Im letzten Schritt werden die an Coenzym A gebundenen Zwischenprodukte durch eine zinkhaltige Cinnamalkohol-Dehydrogenase (CAD) (EC 1.1.1.195) zu den Monolignolen reduziert, wobei immer NADPH als Reduktionsmittel verwendet wird.[3] Diese zur Biosynthese von Lignin führenden Alkohole sind p-Cumarylalkohol (H-Einheit), Coniferylalkohol (G-Einheit) und Sinapylalkohol (S-Einheit).[17]
Die Zusammensetzung der Lignine hängt vor allem vom Mengenverhältnis der einzelnen Monolignole und den Reaktionsbedingungen ab.[17] In Bedecktsamigen Pflanzen ist das Lignin insbesondere aus Sinapyl- und Coniferylalkohol aufgebaut, in Nacktsamigen Pflanzen dominiert Coniferylalkohol, und Gräser verwenden alle drei Monolignole. Eine Schlüsselfunktion kommt dabei der CAD zu, die durch ihre unterschiedliche Substratspezifität wahrscheinlich für die unterschiedlichen Anteile der Alkohole in den verschiedenen Pflanzengruppen verantwortlich ist: CAD aus Bedecktsamigen Pflanzen und Gräsern reduziert alle drei Zimtaldehyde, während für das CAD aus Nacktsamigen Pflanzen Sinapylaldehyd nur ein schlechtes Substrat darstellt und entsprechend weniger stark umgesetzt wird.[3]
Ligninsynthese
[Bearbeiten | Quelltext bearbeiten]1948 konnten Karl Freudenberg und Mitarbeiter ein künstliches Lignin (Dehydrisierungspolymerisat) aus Coniferylalkohol und einem Extrakt aus Agaricus campestris (Feldchampignon) herstellen. Ein später aus Fichtenholz isoliertes Lignin zeigte ähnliche chemische und physikalische Eigenschaften wie das künstliche Lignin. Insofern wurde damit indirekt nachgewiesen, dass Coniferylalkohol ein wesentlicher Baustein bei der Fichtenligninbildung ist. Weitere In-vivo-Untersuchungen mit radioaktiv markiertem Coniferylalkohol bzw. Coniferin bestätigten, dass bei der Biogenese des Lignins diese Bausteine eine wesentliche Rolle spielen. Mit diesen Untersuchungen wurde ein Durchbruch in der Ligninforschung erzielt.
Aufgrund der Zusammensetzung aus den einzelnen Bausteinen und den vielfältigen Polymerisierungsmöglichkeiten können Lignine unterschiedlichste Aufbauten besitzen und bilden entsprechend eine ganze Klasse von Verbindungen.[15] Sie werden erst in den interfibrillären Räumen aus den als Vorstufen dienenden Alkoholen aufgebaut. Wie aber die Monolignole aus der Zelle exportiert werden, ist noch nicht ganz geklärt. Wahrscheinlich werden diese als Glucoside – Glucocumarylalkohol, Coniferin und Syringin – nach außen transportiert.[7] Hierbei werden die Alkohole über ihre phenolische OH-Gruppe β-glycosidisch an Zucker (Glucose) gebunden und sind in dieser Form in Wasser besser löslich. So können die Moleküle durch das Plasmalemma und den Apoplast der Zelle transportiert werden und in die Cellulose-Zwischenräume infiltrieren. Schließlich werden durch β-Glycosidasen der Zellwand die Zuckermoleküle abgespalten. Solche β-Glycosidasen wurden bereits in manchen Pflanzen identifiziert.[16] Ob die Monolignole passiv durch die Zellwand diffundieren oder durch ein Transportsystem nach außen gelangen, ist noch Gegenstand der Forschung.
Die exportierten Monolignole werden dann über eine enzymatische Oxidations-Polymerisations-Reaktion spontan zu einer amorphen dreidimensionalen Struktur verknüpft.[18] Hierbei beginnt die Lignifikation an Ecken und der Mittellamelle von Xylemzellen. Den Polymerisationsprozess katalysieren extrazelluläre Peroxidasen aus Wasserstoffperoxid bzw. Laccasen aus Sauerstoff, dabei werden Phenoxyradikale gebildet. Woher indessen das Wasserstoffperoxid stammt, ist noch unklar.[7] Das einzelne Elektron ist über das gesamte Molekül delokalisiert und stabilisiert.[18] Dies ermöglicht verschiedene Knüpfungspunkte für die Bildung des netzartigen Lignins. Lignin enthält chirale Zentren, mit herkömmlichen Methoden kann jedoch keine optische Aktivität nachgewiesen werden.[19]
Ob die Vernetzung gesteuert werden kann, ist noch Gegenstand der Forschung. Möglicherweise können extrazelluläre Glykoproteine, die Dirigenten-Proteine,[20] eine gewisse Spezifität bei der Vernetzung bewirken.[7][21][22]


Die Lignineinlagerung verläuft in drei Phasen. In der ersten Phase lagert sich das Makromolekül in die Zellecken und die Mittellamelle, nachdem die Pektineinlagerung in die Primärwand abgeschlossen ist. Anschließend erfolgt eine fortschreitende Verholzung der S2-Schicht der Sekundärzellwand. Die Hauptlignifizierung erfolgt nach der Ausbildung der Cellulose-Mikrofibrillen in der S3-Schicht. Innerhalb der drei Phasen und damit in den unterschiedlichen Schichten variiert die Zusammensetzung der Lignine.[3]
Gentechnische Veränderung der Lignin-Biosynthese
[Bearbeiten | Quelltext bearbeiten]Da die Entfernung des Lignins aus dem Holz für die Zellstoffproduktion und vor allem für die Herstellung von Biokraftstoffen (Cellulose-Ethanol)[23] zu den aufwändigsten Produktionsschritten gehört, gibt es verschiedene Bemühungen, die Ligninmenge bereits im Holz durch grüne Gentechnik zu reduzieren. Dies geschieht vor allem durch Eingriffe in die für die Synthese der Monomere notwendigen Gene, unter anderem durch „Ausschalten“ der Cinnamalkohol-Dehydrogenase (CAD) und der Kaffeesäure-O-Methyltransferase (COMT) durch Antisense-RNA.[24]
Die entsprechenden Techniken befinden sich aktuell vor allem an Pappeln und Weiden noch in der Erforschung für den Anbau in Kurzumtriebsplantagen und wurden für die technische Umsetzung noch nicht realisiert, eine effektivere Delignifizierung im Zellstoffprozess konnte jedoch bereits nachgewiesen werden.[24] Allerdings wurde festgestellt, dass der Effekt der Ligninreduktion nicht gleichmäßig ist, und Umwelteinflüsse wahrscheinlich einen größeren Einfluss auf die Ligninproduktion haben als die Genveränderung.[25]
Ligninabbau
[Bearbeiten | Quelltext bearbeiten]Lignin kann sowohl biologisch als auch durch verschiedene chemisch-technische Verfahren abgebaut werden. Beim biologischen Ligninabbau wird Holz durch Bakterien und vor allem Pilze (Destruenten) zersetzt. Höher organisierte Lebewesen sind nicht zum Ligninabbau fähig. Der technische Lignin-Aufschluss ist dagegen Teil von Prozessen mit dem Ziel, Lignin und Cellulose im Holz zu trennen und unterschiedlich zu verwerten. Er spielt entsprechend vor allem bei der Zellstoffherstellung, der Holzverzuckerung und bei der Nutzung von Lignocellulose in der Bioraffinerie eine große Rolle. Die gängigen thermochemischen Methoden des technischen Ligninabbaus sind sehr energieaufwändig, belasten die Umwelt und erzeugen Toxine.
Ist verarbeitetes und unbeschichtetes Holz über einen langen Zeitraum Ultraviolettstrahlung ausgesetzt, so wird es oberflächlich geschädigt, wobei vor allem das Lignin denaturiert wird. Im Falle direkter Bewitterung wird es nachfolgend vom Regenwasser ausgewaschen. Die Oberfläche wirkt dann schmutzig-grau. Wirkt kein Regenwasser ein, erhält das Holz infolge der UV-Wirkung eine silbrig-weiße Farbe.
Biologischer Abbau
[Bearbeiten | Quelltext bearbeiten]

Lignin ist durch seine komplexe Vernetzung ein persistenter Naturstoff und kann von Destruenten nur sehr langsam zersetzt werden. Die Humusbildung des Bodens wird dabei größtenteils durch den Ligninabbau gefördert.[26] Holz wird dabei in zwei teilweise parallel ablaufenden Fraktionen abgebaut: Cellulose wird in Form der Braunfäule abgebaut, bei der sich das Holz durch zurückbleibendes Lignin braun verfärbt, während Lignin in Form der Weißfäule abgebaut wird, bei der sich das Holz hell verfärbt.
Beim biologischen Ligninabbau unterscheidet man zwischen dem Verwerten bereits gelöster Ligninfragmente und dem eigentlichen Abbau des Naturstoffes. Erstere können bereits von vielen Bakterien verwertet werden, insbesondere Actinomyceten und Streptomyceten. Weißfäulepilze wie der Zunderschwamm (Fomes fomentarius), der Graue Feuerschwamm (Phellinus igniarius), die Schmetterlingstramete (Trametes versicolor) und Phanerochaete chrysosporium[27] zerstören hingegen enzymatisch den Ligninanteil des Holzes, um ihr eigentliches Substrat, Cellulose bzw. Hemicellulosen, zu verwerten. Entsprechend verfärbt sich bei der Weißfäule das Holz weiß und wird faserig. Die meisten dieser Pilze bauen gleichzeitig das Lignin und die Kohlenhydrate ab (Simultanfäule), die Abbauraten sind ebenfalls ähnlich hoch. Andere Pilze bauen den Ligninanteil anfänglich schneller ab, und es kommt zu einer Celluloseanreicherung (sukzessive Weißfäule). Dies findet man beispielsweise beim Mosaikschichtpilz (Xylobolus frustulatus) oder beim Wurzelschwamm (Heterobasidion annosum), der die Rotfäule bei Fichten bedingt.[28]
Der Ligninabbau findet dabei immer unter aeroben Bedingungen statt und ist sehr energieintensiv. Er kann entsprechend nicht als alleinige Kohlenstoff- und Energiequelle dienen.[29] Daher handelt es sich bei Weißfäulepilzen immer um einen Cometabolismus in Verbindung mit anderen Kohlenstoffquellen. Für den Abbau bilden die Pilze fadenförmige Hyphen aus, die das Lignin durchdringen. Für den Ligninabbau werden verschiedene Enzyme eingesetzt, die vom Pilz durch Exozytose in das Medium abgegeben werden und in das Lignin diffundieren.[26] Der Abbau des Lignins ist de facto eine Depolymerisierung und erfordert Peroxidasen und Laccasen, die sich in ihrer Wirkung synergetisch verhalten. Darüber hinaus werden Sauerstoff, Coenzyme, Metalle und Komplexbildner benötigt.[30]
Die Pilze setzen zunächst Glyoxal frei, das durch Sauerstoff durch eine Glyoxaloxidase zu Oxalsäure und Wasserstoffperoxid (H2O2) oxidiert wird. H2O2 wird dann von einer Mangan-Peroxidase (MnP) (EC 1.11.1.13) zu Wasser reduziert, während Mangan(II) (Mn2+) zu Mn3+ oxidiert wird. Mn3+ wird chelatisiert und dringt als kleines aktives Oxidans leicht in das Lignin ein. Mn3+ kann dort den phenolischen Bestandteilen des Lignins einzelne Elektronen entreißen, so dass ein Radikalkation gebildet wird. Dieses wird in mehrere Bruchstücke gespalten,[29] häufig in Benzaldehydderivate.[31]
Das Radikal-Kation kann auch durch eine Lignin-Peroxidase (LiP) (EC 1.11.1.14) gebildet werden. LiPs sind Häm-enthaltende Enzyme, die substituierte Aromaten, den Hauptbestandteil im Lignin, direkt oxidieren können. Nicht alle Weißfäulepilze kodieren jedoch für LiPs.[31] Die Peroxidase verbraucht Wasserstoffperoxid als Oxidationsmittel.
Mittlerweile hat man auch Hybridenzyme in Pleurotus, Bjerkandera und anderen Pilzen entdeckt, die man als „versatile peroxidases“ (VP) (EC 1.11.1.16) bezeichnet.[31] Diese verfügen sowohl über eine Mangan-Peroxidase- als auch über eine Lignin-Peroxidase-Aktivität.
Laccasen (EC 1.10.3.2) schließlich oxidieren hauptsächlich niedermolekulare Bruchstücke des Lignins.[29] Sie können zwar generell phenolische Komponenten des Lignins enzymatisch angreifen. Da aber jene Komponenten nur 10 Prozent des Lignins ausmachen, wird das Makromolekül primär von den oben genannten Peroxidasen verwertet.[32]
Beim Ligninabbau sind darüber hinaus noch viele weitere Enzyme (Oxidoreduktasen, Dehydrogenasen) beteiligt.[32]
Technischer Abbau
[Bearbeiten | Quelltext bearbeiten]Zellstoffherstellung im Sulfat- und Sulfitprozess
[Bearbeiten | Quelltext bearbeiten]Der technische Ligninabbau spielt vor allem bei der Zellstoffherstellung eine wichtige Rolle. Zur Produktion von Zellstoff muss das Lignin aus der Lignocellulose gelöst und entfernt werden. Dabei existieren unterschiedliche Verfahren für den Celluloseaufschluss sowie für die nachfolgende Zellstoffbleiche.

Etwa 80 Prozent aller Zellstoffanlagen erfolgt der Aufschluss über das so genannte Sulfatverfahren, auch bekannt als Kraft-Prozess. Dabei erfolgt der Ligninabbau durch Hydrogensulfidionen (HS−) in basischem Milieu bei etwa pH 13 durch den Einsatz von Natriumsulfid (Na2S) und Natriumhydroxid (NaOH) bzw. Natronlauge. Der Prozess dauert etwa zwei Stunden bei Temperaturen von etwa 170 °C, allerdings greifen die Ionen auch die Cellulose und die Hemicellulosen an, wodurch nur ein Teilaufschluss möglich ist. Die Ablauge dieses Verfahrens enthält in ihrer Festsubstanz bei der Verwendung von Nadelhölzern etwa 45 Prozent und bei Laubhölzern etwa 38 Prozent des sogenannten Kraft-Lignins.
Eine Alternative stellt der Celluloseaufschluss im Sulfitverfahren dar, bei dem das Lignin durch eine Sulfonierung abgebaut wird. Als chemisch nicht exakt definiertes Umsetzungsprodukt des Lignins mit Schwefliger Säure entstehen Ligninsulfonate, die Salze der Ligninsulfonsäure. Calciumsalze der Ligninsulfonsäure entstehen beim Aufschluss des Holzes mit Calciumhydrogensulfit-Lösungen. Hier enthält die Ablauge in ihrer Festsubstanz bei der Verwendung von Nadelhölzern etwa 55 Prozent und bei Laubhölzern etwa 42 Prozent in Form von Ligninsulfonat.
Lignin ist für das Vergilben von Papier verantwortlich, das daher mit ligninabbauenden Enzymen wie der Laccase gebleicht werden kann. Gebleicht wird allerdings vor allem über eine Chlorbleiche bzw. heutzutage meistens „chlorfrei“ mit Sauerstoff, Chlordioxid, oder seltener Wasserstoffperoxid bzw. Ozon. In beiden Fällen werden das Restlignin sowie vorhandene Farbstoffe im Zellstoff oxidativ abgebaut. Dies ist vor allem bei holzhaltigem Papier relevant, weniger bei holzfreiem. Die Begriffe holzhaltig und holzfrei sind zwar im Handel und umgangssprachlich üblich, technisch jedoch unsinnig, da Papier aus dem Rohstoff Holz in jedem Fall Holzbestandteile enthält. Bei holzfreiem Papier sind dies eben nur die Cellulose und die Hemicellulosen, bei holzhaltigem der ligninhaltige Holzstoff. Korrekt wären daher die Begriffe ligninhaltig und ligninfrei.
Holzverzuckerung
[Bearbeiten | Quelltext bearbeiten]Zur Transformation von Holz zu verwertbaren Zuckern (Holzverzuckerung) werden unterschiedliche chemische, hydrothermische und enzymatische Prozesse angewandt, die das Lignin aus dem Holz entfernen und die Cellulose verfügbar machen.
Historisch bedeutsam sind vor allem technische Anwendungen unter Einsatz von Säuren, vor allem von Salzsäure (HCl) oder verdünnter Schwefelsäure (H2SO4), in denen das zerfaserte Holz gekocht wird. Dabei lagern sich Wassermoleküle an die Cellulose und bilden Oligosaccharide, vor allem Di- oder Trisaccharide, unter anderem mit Glucoseanteil. Aufgrund der im Holz neben der Cellulose vorhandenen Hemicellulose und des Lignins entstehen Nebenprodukte bzw. Verunreinigungen, die das Ergebnis fast ausschließlich zur Produktion zu Alkohol (aus Hexosen) und Hefe (aus Pentosen) verwendbar machen. Zeitweise wurde so der Holzbranntwein erzeugt. Für die Verwendung in der chemischen Industrie muss die Lösung aufwendig gereinigt und entsalzt werden.
Ligninlösung für die Bioraffinerie
[Bearbeiten | Quelltext bearbeiten]Im Kontext der Entwicklung der Bioraffinerie soll die Verzuckerung über spezielle Enzyme, die Cellulasen, auf biotechnologischem Weg stattfinden. Als Ergebnis erhofft man sich möglichst reine Fraktionen der Cellulose zur weiteren Verzuckerung, der Hemicellulosen und des Lignins, um alle drei Bestandteile des Holzes weiterverwenden zu können.
Um die einzelnen Fraktionen möglichst rein und unbeschadet aus dem Holz zu bekommen, bedarf es einer speziellen Vorbehandlung. Diese erfolgt je nach technischem Weg unterschiedlich und kann beispielsweise auf der Behandlung mit Lösemitteln wie Ethanol (Organosolv-Verfahren) oder Ionischen Flüssigkeiten, der Nutzung von Enzymen oder der Dampfbehandlung (Aquasolv-Verfahren) basieren.
Verwendung
[Bearbeiten | Quelltext bearbeiten]
Lignin wird – sieht man von der Verwendung in Form von Holz ab – vor allem als Koppelprodukt der Papier- und Zellstoffindustrie genutzt. Weltweit werden jährlich aktuell etwa 50 Millionen Tonnen Lignin auf diese Weise produziert.[33] Das anfallende Kraft-Lignin und die Ligninsulfonate sind dabei in den jeweiligen Ablaugen gelöst und können aus diesen extrahiert werden. Die Hauptverwendung für beide Lignintypen besteht derzeit aus der energetischen Nutzung (also Nutzung der Verbrennungswärme), weitere Verwendungen liegen vor allem für Lignosulfonate aus dem Sulfitverfahren vor.
Grundsätzlich unterscheiden sich die verschiedenen technischen Lignine in mehreren Eigenschaften, die ihre Nutzung beeinflussen können. Der wesentliche Unterschied liegt in der Molekülgröße: Kraft-Lignin hat eine molare Masse von 2000 bis 3000 g/mol, während Lignosulfonate molare Massen von 20.000 bis 50.000 g/mol erreichen. Organosolv-Lignin liegt bei 1000 bis 2000 g/mol. Lignosulfonate enthalten zudem einen Schwefelanteil von 4 bis 8 Prozent und wenige phenolische Hydroxygruppen (–OH) gegenüber 1 bis 1,5 Prozent Schwefelanteil und vielen phenolischen Hydroxygruppen beim Kraft-Lignin und vielen phenolischen Hydroxidionen (OH−) ohne Schwefelanteil beim Organosolv-Lignin.[34]
Intensiv werden die Eigenschaften des durch oxidative Ammonolyse modifizierten Lignins als Humusersatzstoff untersucht.[35] Die stickstoffhaltigen Lignine ähneln in ihrer Struktur den Huminstoffen und eignen sich als Depotdünger. Die N-Lignine eignen sich auch für die Rekultivierung von Bergbaufolgelandschaften.[36]
Die direkte Verwendung technischer Lignine als Rohprodukte ist sehr eingeschränkt, da es eine Reihe von Nachteilen gibt, die dieser entgegenstehen. So ist Lignin aufgrund seiner sehr komplexen Struktur und der damit verbundenen Inhomogenität nur sehr begrenzt für Anwendungen einsetzbar, da in der Regel genauer definierte Eigenschaften des Rohmaterials erforderlich sind. Hinzu kommt der hohe Grad an Verunreinigungen in den Ablaugen sowie der hohe Schwefelanteil in den Lignintypen, die komplexe Reinigungsschritte erforderlich machen. Die dadurch sehr aufwändige Gewinnung aus den Ablaugen führt dazu, dass ungereinigtes technisches Lignin bis jetzt im Wesentlichen nur für geringerwertige Anwendungen wie die energetische Nutzung oder als unspezifische Klebstoffkomponente und als Dispergiermittel verwendet wird. Darüber hinausgehende stoffliche Verwendungen liegen entweder in der direkten Verwendung von Ligninsulfonaten oder in der chemischen Modifikation durch die Anwendung von Pyrolyse, Hydrolyse oder Hydrogenolyse zur Herstellung verschiedener Chemikalien. Diese Wege sind ebenfalls aufwändig und kommen daher nur selten zum Einsatz.[34]
Lignin in der energetischen Nutzung
[Bearbeiten | Quelltext bearbeiten]Das bei der Papierherstellung vor allem im Sulfatverfahren in großen Mengen als Reststoff anfallende Lignin wird als Schwarzlauge vor allem als Brennstoff direkt in den Zellstofffabriken genutzt. Es dient neben der Energiegewinnung für die Fabriken selbst mit einer Deckung von 80 bis 100 Prozent des Energiebedarfs[33] auch zur Gewinnoptimierung durch den Verkauf von Wärme und Elektrizität.
In der Herstellung von Holzpellets als Energieträger bildet das holzeigene Lignin das Bindemittel. Fein gemahlenes Holz wird beim Pressen erhitzt, das Lignin verflüssigt sich und bindet die Holzpartikel beim Abkühlen zusammen. Frische Pellets riechen deshalb noch stark nach Lignin.
Einsatz von Ligninsulfonaten
[Bearbeiten | Quelltext bearbeiten]Große Mengen an Ligninsulfonaten werden in einem breiten Spektrum von Anwendungen eingesetzt, in denen man vor allem ihre Eigenschaften als Polyelektrolyt, ihre Adsorptionswirkung, die geringe Viskosität und die dunkle Farbe nutzt. Sie sind physiologisch und für die Umwelt relativ unbedenklich, wodurch sie auch in sensiblen Bereichen verwendet werden. Der Hauptanteil der Produktion von etwa 1.000.000 Tonnen pro Jahr (jato)[37] findet Verwendung als Dispergiermittel in Beton und Zement (ca. 100.000 jato), als Zusatz zu Bohrflüssigkeiten (ca. 100.000 jato) sowie als Bindemittel in Pellets für Tiernahrung, in Düngemitteln und anderen Agrochemikalien, Spanplatten, Briketts sowie in Drucktinte und Gießsandkernen. Außerdem werden Lignosulfonate als Papieradditiv, als Dispergier- und Emulgiermittel in Lacken und Farben sowie als Zuschlagstoff in Gips und Gerbstoffen eingesetzt.[34]
Neuere Entwicklungen in der Lignosulfonat-Chemie nutzen die polyelektrolytischen Eigenschaften des Lignins und zielen auf einen Einsatz in der Medizin, der Feinchemie und der Verbesserung der Bodenwasserspeicherung.
Lignin als Biowerkstoff
[Bearbeiten | Quelltext bearbeiten]
Lignin stellt als Naturstoff ein hochkomplexes Makromolekül (Polymer) dar, eine Nutzung dieser Struktur als Biowerkstoff bietet sich entsprechend an. Das Kraft-Lignin aus dem Sulfatprozess der Papierherstellung muss aber zunächst gereinigt werden, daher gibt es bis heute erst wenige Ansätze, auf Lignin basierende Polymere herzustellen.
Im Jahr 1998 wurde von der Firma Tecnaro ein natürlicher Biowerkstoff entwickelt, der den Namen Arboform erhielt und allgemein als „Flüssigholz“ bezeichnet wird. Er basiert auf Lignin, dem Naturfasern wie Flachs oder Hanf beigemischt werden, und kann mit etablierten Kunststoffverarbeitungsformen verarbeitet werden, insbesondere im Spritzguss, der Extrusion, in Pressverfahren sowie durch Tiefziehen und Blasformen.[38][39]
Sowohl das Lignin als auch verschiedene Ligninderivate können als Bausteine in Duroplasten oder in Kunststoffen als Füllstoffe eingesetzt werden. Sie wirken hierbei als Phenolharzkomponente. Durch die Reaktion mit Epichlorhydrin können Epoxidharze hergestellt werden, die bei einer Kondensierung mit Alkalilignin in Polyalkoholen resultieren. Mit Isocyanaten lassen sich diese zu Polyurethanen umsetzen. Bei der Reaktion des Lignins mit Formaldehyd entstehen Phenoplaste, und bei der Vernetzung mit Copolymeren wie Harnstoff, Melamin und Furanen über Formaldehyd entstehen verschiedene Harze (Harnstoff-Formaldehyd-Harze, Melaminharze, und Furanharze bzw. Syntactics). Insbesondere ligninbasierte Phenoplaste stellen eine potenzielle Alternative zu gesundheitlich bedenklichen Phenolen und Formaldehyd als Bindemittel in Spanplatten und anderen Holzwerkstoffen dar; durch ihre hochmolekulare Struktur sind sie weniger flüchtig und löslich, zudem werden sie als physiologisch unbedenklich eingestuft.[34]
Lignin wird an der TU Hamburg als Ausgangsmaterial für die Erzeugung eines Aerogels genommen, das als Dämmstoff eingesetzt werden kann.[40]
Lignin in der chemischen Industrie und Bioraffinerie
[Bearbeiten | Quelltext bearbeiten]Obwohl Lignin keine große Rolle bei der Herstellung von Chemikalien spielt, wird dem Rohstoff für die Zukunft ein großes Potenzial prognostiziert. Insbesondere in den letzten Jahren konzentrierte sich die Forschung auf die Nutzung des Lignins der Zellstoffindustrie und der (noch hypothetischen) Bioraffinerie. Ziel der Forschung ist es, möglichst hochwertige Produkte aus dem Lignin zu gewinnen.[33][41][42]
Bereits jetzt wird Lignin zur Herstellung von Vanillin verwendet, das als naturidentischer Geschmacksstoff für Vanille eingesetzt wird. Es entsteht bei der Oxidation von Ligninsulfonaten, die wiederum durch die saure Hydrolyse aus Lignin gewonnen wird. Über eine Alkalischmelze lassen sich aus Lignin verschiedene Phenole, Carbonsäuren, Teer und Dimethylsulfid (DMS) herstellen. Die Herstellung von DMS ist zudem über eine alkalische Demethylierung möglich und kann weiteroxidiert werden zu Dimethylsulfoxid (DMSO), einem wichtigen Lösungsmittel. Durch Hydrogenolyse wiederum können ebenfalls Phenole, Teer, Benzol und Öle hergestellt werden.[33]
Eine wichtige Option zur zukünftigen Nutzung des Lignins stellt zudem die Pyrolyse dar, ein Verfahren zur thermischen Spaltung organischer Verbindungen bei hohen Temperaturen. So lassen sich durch Pyrolyse bei Temperaturen von 400 bis 500 °C Phenole, Methan, Kohlenmonoxid und Aktivkohle gewinnen. Bei Temperaturen von 700 bis 1.000 °C lässt sich Lignin zu Syngas, Ethen und Benzol spalten, und bei einer Lichtbogen-Pyrolyse entsteht Acetylen.[33]
Energiespeicherung
[Bearbeiten | Quelltext bearbeiten]Die chemischen Eigenschaften von Lignin in Kombination mit seiner Umweltfreundlichkeit, seiner weiten Verfügbarkeit und seinen niedrigen Kosten machen Lignin zu einem vielversprechenden Rohstoff für metallfreie Redox-Flow-Batterien zur Energiespeicherung, insbesondere für die stationäre Speicherung von Strom aus erneuerbaren Energien.[43] 2022 gaben Northvolt und Stora Enso bekannt, künftig „holzbasierte Batterien“ entwickeln zu wollen.[44][45]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Peter Sitte, Elmar Weiler, Joachim W. Kadereit, Andreas Bresinsky, Christian Körner: Lehrbuch der Botanik für Hochschulen. Begründet von Eduard Strasburger. 35. Auflage. Spektrum Akademischer Verlag, Heidelberg 2002, ISBN 3-8274-1010-X.
- Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 2. Auflage. VCH, Weinheim u. a. 1994, ISBN 3-527-30031-7.
- Peter Schopfer, Axel Brennicke: Pflanzenphysiologie. 4. Auflage. Springer, Heidelberg / Berlin 1999, ISBN 3-540-64231-5.
- Lincoln Taiz, Eduardo Zeiger: Plant physiology. Das Original mit Übersetzungshilfen. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg / Berlin 2007, ISBN 978-3-8274-1865-4.
- Peter Nuhn: Naturstoffchemie. Mikrobielle, pflanzliche und tierische Naturstoffe. unter Mitarbeit von Ludger Wessjohann. 4. Auflage. S. Hirzel Verlag, Stuttgart 2006, ISBN 3-7776-1363-0, S. 320–322.
- W. Boerjan, J. Ralph, M. Baucher: Lignin biosynthesis. In: Annu Rev Plant Biol, 2003, 54, S. 519–546; PMID 14503002; doi:10.1146/annurev.arplant.54.031902.134938
- Gerhard Krüger: Lignin – seine Bedeutung und Biogenese. In: Chemie in unserer Zeit, 10. Jahrg., 1976, Nr. 1, S. 21–29, doi:10.1002/ciuz.19760100104
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu Lignin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2012.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d e Lignin. In: Sitte et al. 2002, S. 353–356.
- ↑ Nach Lüttge, Kluge, Bauer, 1994, S. 217.
- ↑ a b c d e f Sekundärwände von Faser- und Holzzellen. In: Sitte et al. 2002, S. 95–96.
- ↑ a b c Peter Raven, Ray F. Evert, Susan Eichhorn: Biologie der Pflanzen. 4. Auflage. de Gruyter, Berlin / New York 2006, ISBN 3-11-018531-8, S. 38 (englisch: Biology of Plants. Übersetzt von B. Biskup u. a.).
- ↑ a b c d Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, 2008, ISBN 978-3-8274-1961-3, S. 420–422.
- ↑ C.F. Delwiche, L.E. Graham, N. Thomson: Lignin-like compounds and sporopollenin in Coleochaete, an algal model for land plant ancestry. Science 245 (1989), S. 399–401.
- ↑ Peter Raven, Ray F. Evert, Susan Eichhorn: Biologie der Pflanzen. 4. Auflage. de Gruyter, Berlin / New York 2006, ISBN 3-11-018531-8, S. 398 (englisch: Biology of Plants. Übersetzt von B. Biskup u. a.).
- ↑ Patrick T. Martone1, José M. Estevez, Fachuang Lu, Katia Ruel, Mark W. Denny, Chris Somerville, John Ralph: Discovery of Lignin in Seaweed Reveals Convergent Evolution of Cell-Wall Architecture. Current Biology 19(2), 27. Januar 2009, S. 169–175.
- ↑ a b c Oskar Faix: Chemie des Holzes. In: André Wagenführ, Frieder Scholz (Hrsg.): Taschenbuch der Holztechnik. Fachbuchverlag im Carl Hanser Verlag, Leipzig 2008, ISBN 978-3-446-22852-8, S. 127–259.
- ↑ a b Die verholzte Pflanzenzelle. In: Schopfer & Brennicke 1999, S. 33.
- ↑ Hans Günther Hirschberg: Handbuch Verfahrenstechnik und Anlagenbau. Springer Verlag 1999, S. 436.
- ↑ Jaakko Pöyry Consulting Oy: Non-wood Fibre. Helsinki 1998.
- ↑ a b Nach Lüttge, Kluge, Bauer, 1994, S. 153.
- ↑ a b K. Marjamaa et al.: The role of xylem class III peroxidases in lignification. In: J Exp Bot, 2009, 60(2), S. 367–376; PMID 19264758; doi:10.1093/jxb/ern278.
- ↑ a b Gerhard Michal (Hrsg.): Biochemical pathways. Biochemie-Atlas. Spektrum Akademischer Verlag, Heidelberg 1999, ISBN 3-86025-239-9, S. 64.
- ↑ a b Peter Karlson, Detlef Doenecke, Jan Koolman, Georg Fuchs, Wolfgang Gerok: Karlsons Biochemie und Pathobiochemie. 15. überarb. und neugestaltete Auflage. Thieme, Stuttgart 2005, ISBN 3-13-357815-4, S. 451.
- ↑ J. Ralph et al.: Are lignins optically active? In: J Agric Food Chem, 1999, 47(8), S. 2991–2996; PMID 10552598; doi:10.1021/jf9901136.
- ↑ LB. Davin et al.: Stereoselective bimolecular phenoxy radical coupling by an auxiliary (dirigent) protein without an active center. In: Science, 1997, 275(5298), S. 362–366; PMID 8994027; doi:10.1126/science.275.5298.362.
- ↑ Laurence B. Davin, Norman G. Lewis: Dirigent Proteins and Dirigent Sites Explain the Mystery of Specificity of Radical Precursor Coupling in Lignan and Lignin Biosynthesis. In: Plant Physiology, 123, 2000, S. 453–461.
- ↑ Ronald Hatfield, Wilfred Vermerris: Lignin Formation in Plants. The Dilemma of Linkage Specificity. In: Plant Physiology, 126, 2001, S. 1351–1357.
- ↑ Ronald J. Dinus: Genetic improvement of poplar feedstock quality for ethanol production. Applied Biochemistry and Biotechnology, 2001, S. 23–34; doi:10.1385/ABAB:91-93:1-9:23.
- ↑ a b G. Pilate, E. Guiney, K. Holt, M. Petit-Conil, C. Lapierre, J.C. Leplé, B. Pollet, I. Mila, E.A. Webster, H.G. Marstorp, D.W. Hopkins, L. Jouanin, W. Boerjan, W. Schuch, D. Cornu, C. Halpin: Field and pulping performances of transgenic trees with altered lignification. Nature Biotechnology, 20. Juni 2002, S. 607–612. PMID 12042866.
- ↑ E.L. Tilstona, C. Halpin, D.W. Hopkin: Genetic modifications to lignin biosynthesis in field-grown poplar trees have inconsistent effects on the rate of woody trunk decomposition. Soil Biology and Biochemistry 36(11), November 2004, S. 1903–1906; doi:10.1016/j.soilbio.2004.05.010.
- ↑ a b Hans G. Schlegel: Allgemeine Mikrobiologie. Hrsg.: Georg Fuchs. 8., vollständig überarbeitete und erweiterte Auflage. Thieme, Stuttgart 2007, ISBN 978-3-13-444608-1, S. 293–294.
- ↑ D. Singh, S. Chen: The white-rot fungus Phanerochaete chrysosporium: conditions for the production of lignin-degrading enzymes. In: Appl Microbiol Biotechnol, 2008, 81(3), S. 399–417; PMID 18810426; doi:10.1007/s00253-008-1706-9.
- ↑ Olaf Schmidt: Holz- und Baumpilze. Biologie, Schäden, Schutz, Nutzen. Springer, Heidelberg / Berlin 1994, ISBN 3-540-57334-8.
- ↑ a b c Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme, Stuttgart 2008, ISBN 978-3-13-144861-3, S. 507–508.
- ↑ David N.-S. Hon, Nobuo Shiraishi: Wood and cellulosic chemistry (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c KE. Hammel, D. Cullen: Role of fungal peroxidases in biological ligninolysis. In: Curr Opin Plant Biol, 2008, 11(3), S. 349–355; PMID 18359268; doi:10.1016/j.pbi.2008.02.003.
- ↑ a b AT. Martínez et al.: Biodegradation of lignocellulosics: microbial, chemical, and enzymatic aspects of the fungal attack of lignin. In: Int Microbiol, 2005, 8(3), S. 195–204 (englisch); PMID 16200498; hdl:10261/1996 (PDF).
- ↑ a b c d e Birgit Kamm, Michael Kamm, Matthias Schmidt, Thomas Hirth, Margit Schulze: Lignocellulose-based Chemical Products and Product Family Trees. In: Birgit Kamm, Patrick R. Gruber, Michael Kamm (Hrsg.): Biorefineries – industrial processes and products. Status quo and future directions. Wiley-VCH, Weinheim 2006, ISBN 3-527-31027-4, S. 67–84.
- ↑ a b c d Erich Gruber: Makromolekulare Chemie, Ökologie und Ökonomie der Nachwachsenden Rohstoffe: Nutzung von Lignin. ( vom 27. Juli 2004 im Internet Archive) Unterlagen zur Vorlesung Wintersemester 1999/2000.
- ↑ Universität für Bodenkultur Wien – Forschungsportal. forschung.boku.ac.at, abgerufen am 7. Mai 2009.
- ↑ BOKU FIS: ENLIGMA: N-modifizierte LIGnine als Basis für funktionelle Materialien - BOKU FIS, pdf, abgerufen am 10. August 2024
- ↑ Modifizierte Lignosulfonsäuren (LSS) als Bindemittel für die Herstellung von witterungsbeständigen Holzwerkstoffen (PDF; 1,3 MB), Ralph Lehnen und Okko Ringena, Arbeitsbericht des Instituts für Holzchemie und chemische Technologie des Holzes.
- ↑ Arboblend, Arbofill und Arboform. Tecnaro, abgerufen am 3. Juli 2023.
- ↑ BIB’09 – Branchenführer Innovative Biowerkstoffe 2009. nova-Institut GmbH, Hochschule Bremen (Hrsg.), Hürth 2009, S. 62–63.
- ↑ Joachim Wille: Der neue Super-Dämmstoff. In: klimareporter.de. 7. April 2023, abgerufen am 4. Mai 2023.
- ↑ J. J. Bozell, J. E. Holladay, D. Johnson, J. F. White: Top Value Added Chemicals From Biomass. Volume II—Results of Screening for Potential Candidates from Biorefinery Lignin. Pacific Northwest National Laboratory (PNNL) and the National Renewable Energy Laboratory (NREL), Oktober 2007; pnl.gov (PDF; 802 kB).
- ↑ Transparentes und hitzestabiles Polyamid – 100 Prozent biobasiert. fraunhofer.de, 29. August 2018; abgerufen am 31. Juli 2020.
- ↑ Alolika Mukhopadhyay et al.: Metal-Free Aqueous Flow Battery with Novel Ultrafiltered Lignin as Electrolyte. In: ACS Sustainable Chemistry & Engineering. Band 6, Nr. 4, 2018, S. 5394–5400, doi:10.1021/acssuschemeng.8b00221.
- ↑ Stora Enso & Northvolt partner to develop wood-based battery. In: Northvolt. 19. Juli 2022, abgerufen am 8. August 2022 (englisch).
- ↑ Frank Wunderlich-Pfeiffer: Akkutechnik. Was hat es mit der "Holzbatterie" von Northvolt auf sich? In: Golem.de. 5. August 2022, abgerufen am 8. August 2022.