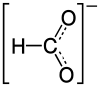
Lithiumformiat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumformiat | |||||||||||||||
| Andere Namen |
Lithiummethanoat | |||||||||||||||
| Summenformel | CHLiO2 | |||||||||||||||
| Kurzbeschreibung |
weißes kristallines Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,46 g·cm−3 (20 °C)[1] (Monohydrat) | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Lithiumformiat ist das Lithiumsalz der Ameisensäure. Es ist im Handel als Monohydrat in Form von weißen Kristallen mit der stöchiometrischen Zusammensetzung Li(HCOO)·H2O erhältlich.[3]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Lithiumformiat kann durch Salzbildungsreaktion aus Lithiumhydroxid und Ameisensäure hergestellt werden.
Ebenso ist die Synthese aus Lithiumcarbonat und Ameisensäure unter Entwicklung von Kohlendioxid möglich.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Lithiumformiat kristallisiert im orthorhombischen Kristallsystem[5] in der Raumgruppe Pna21 (Raumgruppen-Nr. 33) mit den Gitterparametern a = 699 pm, b = 650 pm und c = 485 pm. In der Elementarzelle befinden sich vier Formeleinheiten.[6]
Das Monohydrat geht bei 94 °C unter Wasserabspaltung in das Anhydrid über.[7] Bei weiterem Erhitzen zersetzt sich Lithiumformiat bei 230 °C[6] unter Bildung von Lithiumcarbonat, Kohlenmonoxid und Wasserstoff.[4]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Große Mengen von Lithiumformiat haben wie alle wasserlöslichen Lithiumsalze eine toxische Wirkung auf das zentrale Nervensystem. Bei wiederholter Einnahme können auch die Nieren geschädigt werden.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Lithiumformiat bei Alfa Aesar, abgerufen am 26. Mai 2010 (Seite nicht mehr abrufbar).
- ↑ a b Datenblatt Lithium formate monohydrate bei Sigma-Aldrich, abgerufen am 8. April 2011 (PDF).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Lithiumformiat-Monohydrat: CAS-Nr.: 6108-23-2, EG-Nr.: 676-657-8, ECHA-InfoCard: 100.201.853, PubChem: 23702287, ChemSpider: 11251293, Wikidata: Q18212206.
- ↑ a b T. Meisel, Z. Halmos, K. Seybold, E. Pungor: "The thermal decomposition of alkali metal formates", in: Journal of Thermal Analysis and Calorimetry, 1975, 7 (1), S. 73–80 doi:10.1007/BF01911627
- ↑ R. Abegg, F. Auerbach, I. Koppel: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, 1908. S. 149; Volltext.
- ↑ a b Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 532 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Erich Groschuff: "Neutrale und saure Alkaliformiate. Studien über die Löslichkeit der Salze. XI.", in: Berichte der deutschen chemischen Gesellschaft, 1903, 36 (2), S. 1783–1795 doi:10.1002/cber.19030360276.
- ↑ Datenblatt Lithium formate hydrate (PDF) bei Strem, abgerufen am 25. Dezember 2012.



![{\displaystyle {\ce {2HCOOLi ->[\Delta] Li2CO3 + CO ^ + H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd2481d55ca822cfb281260e5b48ec4ef1fd436e)