Lolinalkaloide
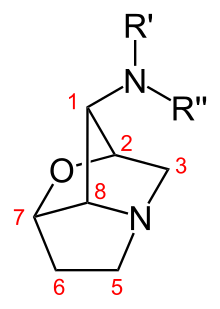
Lolinalkaloide, kurz auch Loline genannt, sind zu den Alkaloiden zählende bioaktive Naturstoffe. Lolinalkaloide werden insbesondere von den symbiotisch auf und in Süßgräsern lebenden Pilzen aus der Familie der Mutterkornpilzverwandten produziert. Sie wirken als natürliche Insektizide und dienen sowohl dem Pilz als auch der Wirtspflanze als Fraßschutz. Chemisch zählen die Lolinalkaloide mit ihrer 1-Amino-2,7-Epoxypyrrolizidinstruktur zu den Pyrrolizidinalkaloiden.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Lolinalkaloide können insbesondere in Süßgräsern, insbesondere in Vertretern der Gattungen Lolium, Festuca und Poa, gefunden werden.[1] Für die Produktion dieser Alkaloide ist jedoch nicht die Pflanze, sondern eine Infektion mit endophytischen Pilzen der Gattung Epichloë (und seiner als Neotyphodium bezeichneten Anamorphen) aus der Familie der Mutterkornpilzverwandten verantwortlich.
Außerhalb der symbiotischen Gemeinschaft aus Süßgras und Endophyt kommen Lolinalkaloide nur vereinzelt in der Natur vor. So wurde über ein Vorkommen von Lolinalkaloiden in Adenocarpus hispanicus (Familie: Hülsenfrüchtler) und Argyreia mollis (Familie: Windengewächse) berichtet.[2][3]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Trotz ihrer strukturellen Zugehörigkeit zur Gruppe der Pyrrolizidinalkaloide unterscheidet sich die Biosynthese der Lolinalkaloide deutlich von der anderer Pyrrolizidinalkaloide. Lolinalkaloide leiten sich im Gegensatz zu anderen Pyrrolizidinalkaloiden nicht vom Ornithin oder Arginin ab, sondern werden aus den Aminosäuren Prolin und Homoserin gebildet.[4] Als primäres Biosyntheseprodukt wird 1-Acetamidopyrrolizidin gebildet, welches zu Acetyltemulin cyclisiert wird. Weitere Lolinalkaloide leiten sich biosynthetisch von dieser Substanz ab. An der Biosynthese der Lolinalkaloide sind verschiedene Enzyme des LOL-Genclusters beteiligt.[5]
Chemie
[Bearbeiten | Quelltext bearbeiten]Struktur
[Bearbeiten | Quelltext bearbeiten] |

|
| Temulin | Lolin |
Lolinalkaloide sind trizyklische Pyrrolizidinalkaloide. Die Vertreter dieser Stoffklasse unterscheiden sich anhand der Substituenten an der Aminogruppe in Position 1 des Lolingrundgerüsts. Die strukturell einfachsten Lolinalkaloide sind Temulin mit einer freien Aminogruppe und sein N-methylierter Abkömmling Lolin. Die weiteren Lolinalkaloide leiten sich von diesen Substanzen ab und tragen verschiedene Acylsubstituenten.[6]
Synthese
[Bearbeiten | Quelltext bearbeiten]Für die Synthese von Lolinalkaloiden sind verschiedene Verfahren beschrieben.[7][8][9][10]
Die von Wilson beschriebene Lolinalkaloidsynthese geht von 8-Oxabicyclo[3.2.1]oct-6-en-3-on aus, welches in mehreren Schritten zum 9-Oxa-4-azabicyclo[4.2.1]non-7-en umgesetzt wird. Eine intramolekulare Ringverknüpfung in Gegenwart von Brom führt zu 2,7-Epoxypyrrolizidin-1-bromid, welches zum Temulin oder zu anderen Lolinalkaloiden aminiert werden kann.[7]
Ausgehend von 1-Ethylpyrrolidin-3-on nach Cope-Eliminierung zum entsprechenden Nitron erfolgt unter Cycloaddition von (E)-Methyl-4-hydroxy-2-butenoat der intermediärer Ringschluss zum Hexahydropyrrolo[1,2-b][1,2]oxazolderivat, welches nach Reduktion der N-O-Bindung im Sinne einer SN2-Reaktion zum Pyrrolizidinderivat umgelagert wird. Eine Williamson-Ethersynthese ermöglicht den Schluss des Tetrahydrofuranrings. Lolin als Endprodukt des Synthesewegs wird durch Curtius-Umlagerung mit anschließender Reduktion ausgehend vom Zwischenprodukt 2,7-Epoxypyrrolizidin-1-carbonsäureethylether erhalten.[8]
Ein weiterer Syntheseweg geht von Divinylcarbinol[11] und 3-Butenylamin[12] und einem Ringschluss zum Heyahydroazocinderivat aus. Nach Azidierung mit Lithiumazid erfolgt in Gegenwart von Brom die transannulare Ringverknüpfung zum Pyrrolizidinderivat im Sinne einer Kombination aus elektrophilen und nukleophilen Substitutionsmechanismen als Schlüsselschritt der Synthese. Der Tetrahydrofuranring wird anschließend durch eine intramolekulare Veretherung geschlossen. Das so erhaltene 2,7-Epoxypyrrolizidin-1-azid kann zum Temulin reduziert oder zum Lolin methyliert und reduziert werden.[10]
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Lolinalkaloide sind neben den Mutterkornalkaloiden, Lolitremen und Peramin ein Bestandteil des Fraßschutzes der symbiotischen Gemeinschaft aus Endophyten der Gattung Epichloë/Neotyphodium und Süßgräsern. Loline besitzen eine insektizide Wirkung auf ein breites Spektrum von Insekten.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Lane, Geoffrey A., Michael J. Christensen, and Christopher O. Miles: Microbial Endophytes. Hrsg.: Charles W. Bacon, James White. CRC Press, 2000, ISBN 1-4200-2711-5, Coevolution of Fungal Endophytes with Grasses The Significance of Secondary Metabolites, S. 341–388.
- ↑ Tofern B, Kaloga M, Witte L, Hartmann T, Eich E: Occurrence of loline alkaloids in Argyreia mollis (Convolvulaceae). In: Phytochemistry. 51. Jahrgang, 1999, S. 1177–1180, doi:10.1016/S0031-9422(99)00121-1.
- ↑ Veen G, Greinwald R, Canto P, Witte L, Czygan FC: Alkaloids of Adenocarpus hispanicus (Lam.) DC varieties. In: Zeitschrift für Naturforschung. 47. Jahrgang, 1992, S. 341–345.
- ↑ J. D. Blankenship, J. B. Houseknecht, S. Pal, L. P. Bush, R. B. Grossman, C. L. Schardl: Biosynthetic precursors of fungal pyrrolizidines, the loline alkaloids. In: ChemBioChem. 6. Jahrgang, Nr. 6, 2005, S. 1016–1022, doi:10.1002/cbic.200400327, PMID 15861432.
- ↑ C. L. Schardl, C. A. Young, U. Hesse, S. G. Amyotte, K. Andreeva, P. J. Calie, D. J. Fleetwood, D. C. Haws, N. Moore, B. Oeser, D. G. Panaccione, K. K. Schweri, C. R. Voisey, M. L. Farman, J. W. Jaromczyk, B. A. Roe, D. M. O’Sullivan, B. Scott, P. Tudzynski, Z. An, E. G. Arnaoudova, C. T. Bullock, N. D. Charlton, L. Chen, M. Cox, R. D. Dinkins, S. Florea, A. E. Glenn, A. Gordon, U. Güldener, D. R. Harris, W. Hollin, J. Jaromczyk, R. D. Johnson, A. K. Khan, E. Leistner, A. Leuchtmann, C. Li, J. Liu, J. Liu, M. Liu, W. Mace, C. Machado, P. Nagabhyru, J. Pan, J. Schmid, K. Sugawara, U. Steiner, J. E. Takach, E. Tanaka, J. S. Webb, E. V. Wilson, J. L. Wiseman, R. Yoshida, Z. Zeng: Plant-symbiotic fungi as chemical engineers: multi-genome analysis of the clavicipitaceae reveals dynamics of alkaloid loci. In: PLoS Genet. 9. Jahrgang, Nr. 2, 2013, S. e1003323–e1003323, doi:10.1371/journal.pgen.1003323, PMID 23468653.
- ↑ a b C. L. Schardl, R. B. Grossman, P. Nagabhyru, J. R. Faulkner, U. P. Mallik: Loline alkaloids: Currencies of mutualism. In: Phytochemistry. 68. Jahrgang, Nr. 7, 2007, S. 980–996, doi:10.1016/j.phytochem.2007.01.010, PMID 17346759.
- ↑ a b Wilson SR, Sawicki RA, Huffman JC: Synthetic and structural studies of the lolium alkaloids. In: J. Org. Chem. 46. Jahrgang, Nr. 19, 1981, S. 3887–3891, doi:10.1021/jo00332a025.
- ↑ a b Tufariello JJ, Meckler H, Winzenberg K: Synthesis of the lolium alkaloids. In: J. Org. Chem. 51. Jahrgang, Nr. 18, 1986, S. 3556–3557, doi:10.1021/jo00368a035.
- ↑ Blakemore PR, Kim SK,Schulze VK,White JD, Yokochia AF: Asymmetric synthesis of (+)-loline, a pyrrolizidine alkaloid from rye grass and tall fescue. In: J Chem Soc, Perkin Trans. 1. Jahrgang, 2001, S. 1831–1847, doi:10.1039/B103936A.
- ↑ a b Cakmak M, Mayer P, Trauner D: An efficient synthesis of loline alkaloids. In: Nat Chem. 3. Jahrgang, Nr. 7, 2011, S. 543–545, doi:10.1038/nchem.1072, PMID 21697875.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,4-Pentadien-3-ol: CAS-Nr.: 922-65-6, EG-Nr.: 213-080-9, ECHA-InfoCard: 100.011.892, PubChem: 70204, Wikidata: Q72499712.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3-Butenylamin: CAS-Nr.: 2524-49-4, EG-Nr.: 680-738-3, PubChem: 443732, ChemSpider: 391842, Wikidata: Q27114138.