Magnesiumhexafluorosilicat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
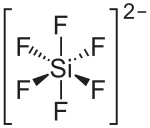
| ||||||||||
| Allgemeines | ||||||||||
| Name | Magnesiumhexafluorosilicat | |||||||||
| Andere Namen | ||||||||||
| Summenformel | MgSiF6 | |||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff (Hexahydrat)[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 166,38 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Dichte |
1,79 g·cm−3 (Hexahydrat)[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten |
200 mg·kg−1 (LD50, Meerschweinchen, oral)[6] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Magnesiumhexafluorosilicat ist eine anorganische chemische Verbindung des Magnesiums aus der Gruppe der Hexafluorosilicate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Magnesiumhexafluorosilicat kann durch Reaktion von Magnesiumverbindungen mit Flusssäure in Gegenwart von Siliciumdioxid gewonnen werden.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Magnesiumhexafluorosilicat ist als Hexahydrat ein kristalliner weißer geruchloser Feststoff, der löslich in Wasser ist.[2] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3).[3] Es sind allerdings auch andere Phasen möglich.[8][9][10]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Magnesiumhexafluorosilicat wird als Härter für Beton und als Wasserschutzchemikalie verwendet.[11] Es dient auch als insektizides Holzschutzmittel im Hochbau.[12]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu MAGNESIUM FLUOROSILICATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Januar 2022.
- ↑ a b c d e Datenblatt Magnesium hexafluorosilicate hexahydrate, 98% bei Alfa Aesar, abgerufen am 23. November 2016 (Seite nicht mehr abrufbar).
- ↑ a b c d R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 562 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Eintrag zu Magnesiumhexafluorosilikat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Eintrag zu Magnesiumhexafluorosilicat im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 27. November 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Michael Ash, Irene Ash: Handbook of Preservatives. Synapse Info Resources, 2004, ISBN 978-1-890595-66-1, S. 843 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Umweltbundesamt: Merkblatt über die besten verfügbaren Techniken für die Herstellung Anorganischer Grundchemikalien: Ammoniak, Säuren und Düngemittel, August 2007.
- ↑ Peter G. Skrylnik, Albert M. Ziatdinov: Incommensurate Phases of the MgSiF6-6H2O Crystals: EPR and Group-Theoretical Studies. In: Applied Magnetic Resonance. 45, 2014, S. 623, doi:10.1007/s00723-014-0542-6.
- ↑ R. Hrabański, V. Kapustianik, V. Kardash, S. Sveleba: Birefringent and piezooptic properties of (MgSiF6) - 6H2O crystals. In: Physica Status Solidi. 142, 1994, S. 509, doi:10.1002/pssa.2211420225.
- ↑ S. Syoyama, K. Osaki: An X-ray study of the low-temperature form of MgSiF6.6H2O and the relation between the crystal lattices of low- and high-temperature forms. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 28, S. 2626, doi:10.1107/S0567740872006624.
- ↑ Richard P. Pohanish: Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. William Andrew, 2011, ISBN 978-1-4377-7869-4, S. 3039 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ralf Steudel: Chemie der Nichtmetalle Von Struktur und Bindung zur Anwendung. Walter de Gruyter, 2008, ISBN 978-3-11-021128-3, S. 282 (eingeschränkte Vorschau in der Google-Buchsuche).


![{\displaystyle \mathrm {MgO+SiO_{2}+6\ HF\longrightarrow Mg[SiF_{6}]+3\ H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/897f0e068141bab15026c5edc572e5eb46a0d0f5)