Malonsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Malonsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C3H4O4 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 104,06 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Dichte |
1,60 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
Zersetzung ab 140 °C[3] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Malonsäure (Propandisäure) ist eine bei Raumtemperatur kristalline Dicarbonsäure, deren Ester und Salze Malonate genannt werden (z. B. Diethylmalonat = Malonsäurediethylester).
Geschichte und Vorkommen
[Bearbeiten | Quelltext bearbeiten]Malonsäure wurde 1858 von Victor Dessaignes bei der Oxidation der Äpfelsäure entdeckt. Der Name leitet sich von lat. malum = Apfel (Pflanzengattung)[2] ab. Malonsäure kommt im Zuckerrübensaft vor.
Biochemie
[Bearbeiten | Quelltext bearbeiten]Bei der mitochondrialen Fettsäuresynthese (mtFASII) bildet Malonsäure das Startsubstrat, welches im ersten Schritt der mtFASII durch das Acyl-CoA-Synthetase-Familienmitglied 3 (ACSF3) in Malonyl-CoA umgewandelt wird.[6][7]
Malonsäure ist ein Zellgift, das durch Hemmung der Succinat-Dehydrogenase den Ablauf des Citratzyklus (Krebszyklus) hemmt.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Malonsäure wird unter anderem durch Umsetzung von Chloressigsäure mit Natriumcyanid (NaCN) (Kolbe-Nitrilsynthese) und anschließender Hydrolyse der entstandenen Cyanessigsäure hergestellt.[2][8]
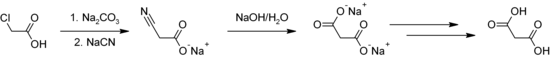
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Malonsäure bildet farb- und geruchlose Kristalle, die einen Schmelzpunkt von 136 °C besitzen und sich in Wasser leicht lösen. Die Verbindung tritt in drei polymorphen Kristallformen auf. Eine γ–Form existiert nur bei tiefen Temperaturen und wandelt sich bei −225,9 °C in die β–Form um. Die Phasenumwandlung von der β–Form zur α–Form erfolgt bei 79 °C. Die Formen α und β bzw. β und γ stehen enantiotrop zueinander.[9] Der Feststoff zersetzt sich oberhalb des Schmelzpunktes unter Kohlenstoffdioxidabspaltung zu Essigsäure. In wässriger Lösung findet diese Decarboxylierung ab 70 °C statt.[2] In höher siedenden Lösungsmitteln, wie Ethylenglycol, Trimethylenglycol, 1,3-Butandiol und 2,3-Butandiol verläuft die Reaktion oberhalb von 100 °C als Reaktion erster Ordnung.[10]

Erhitzt man Malonsäure mit stark wasserentziehenden Mitteln, z. B. mit Phosphorpentoxid, so entsteht durch intramolekulare Wasserabspaltung in schlechter Ausbeute Kohlenstoffsuboxid[2], auch Malonsäureanhydrid genannt.
Malonsäure ist eine CH-acide Verbindung, d. h., durch den elektronenziehenden Effekt der beiden Carboxygruppen kann am zentralen Kohlenstoff leicht ein Proton abgespalten werden.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Malonsäurederivate sind Synthesebausteine bei der Knoevenagel-Kondensation oder der Malonestersynthese und dienen beispielsweise zur Herstellung von Barbitursäure und deren Derivaten. Insbesondere gelang William Henry Perkin, jr. erstmals eine Cyclopropanierung durch Umsetzung des C-H-aciden Malonsäurediethylesters mit 1,2-Dibromethan und zwei Äquivalenten Natriumethanolat. Beim Erhitzen von Gemischen cyclischer Imine mit Malonsäure entstehen β-Aminocarbonsäuren.[11] Es werden jährlich 10 bis 100 Tonnen nach Europa importiert.[12]
Pathologie
[Bearbeiten | Quelltext bearbeiten]Wenn erhöhte Malonsäurespiegel mit erhöhten Methylmalonsäurespiegeln einhergehen, kann dies auf die Stoffwechselerkrankung kombinierte Malon- und Methylmalonazidurie (CMAMMA) hinweisen. Durch die Berechnung des Verhältnisses von Malonsäure zu Methylmalonsäure im Blutplasma kann die CMAMMA von der klassischen Methylmalonazidurie unterschieden werden.[13]
Malonat: Verwechslungsgefahr mit Malat und Maleat
[Bearbeiten | Quelltext bearbeiten]Malonat darf nicht mit dem Säureanion der Äpfelsäure, dem Malat-Ion, oder dem Anion der Maleinsäure, dem Maleat verwechselt werden.[14]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu MALONIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 2. Juli 2020.
- ↑ a b c d e f g h Eintrag zu Malonsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- ↑ a b c d e f g Eintrag zu Malonsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b chem.wisc.edu: pKa Data, Compiled by R. Williams (PDF; 645 kB).
- ↑ Datenblatt Malonic acid bei Sigma-Aldrich, abgerufen am 10. August 2012 (PDF).
- ↑ Andrzej Witkowski, Jennifer Thweatt, Stuart Smith: Mammalian ACSF3 Protein Is a Malonyl-CoA Synthetase That Supplies the Chain Extender Units for Mitochondrial Fatty Acid Synthesis. In: Journal of Biological Chemistry. Band 286, Nr. 39, September 2011, S. 33729–33736, doi:10.1074/jbc.M111.291591, PMID 21846720, PMC 3190830 (freier Volltext).
- ↑ Caitlyn E. Bowman, Susana Rodriguez, Ebru S. Selen Alpergin, Michelle G. Acoba, Liang Zhao, Thomas Hartung, Steven M. Claypool, Paul A. Watkins, Michael J. Wolfgang: The Mammalian Malonyl-CoA Synthetase ACSF3 Is Required for Mitochondrial Protein Malonylation and Metabolic Efficiency. In: Cell Chemical Biology. Band 24, Nr. 6, Juni 2017, S. 673–684.e4, doi:10.1016/j.chembiol.2017.04.009, PMID 28479296, PMC 5482780 (freier Volltext).
- ↑ Nathan Weiner: Malonic acid In: Organic Syntheses. 18, 1938, S. 50, doi:10.15227/orgsyn.018.0050; Coll. Vol. 2, 1943, S. 376 (PDF).
- ↑ Fukai, M.; Matsuo, T.; Suga, H.: Thermodynamic properties of phase transitions in malonic acid and its deuterated analog in Thermochim. Acta 183 (1991) 215–243, doi:10.1016/0040-6031(91)80461-Q.
- ↑ Clark, L.W.: The Kinetics of the Decarboxylation of Malonic Acid and Other Acids in Neutral Solvents in J. Phys. Chem. 71 (1967) 2597–2601, doi:10.1021/j100867a031.
- ↑ Jürgen Martens, Jürgen Kintscher und Wolfgang Arnold: Synthese und Stereochemie von neuen 2-substituierten 4-Thiazolidinylessigsäuren, in: Tetrahedron, 1991, 47, S. 7029–7036, doi:10.1016/S0040-4020(01)96157-5.
- ↑ Malonic acid - Substance Information - ECHA. Abgerufen am 10. Mai 2018 (britisches Englisch).
- ↑ Monique G. M. de Sain-van der Velden, Maria van der Ham, Judith J. Jans, Gepke Visser, Hubertus C. M. T. Prinsen: A New Approach for Fast Metabolic Diagnostics in CMAMMA. In: JIMD Reports. Band 30. Springer Berlin Heidelberg, Berlin, Heidelberg 2016, ISBN 978-3-662-53680-3, S. 15–22, doi:10.1007/8904_2016_531, PMID 26915364, PMC 5110436 (freier Volltext).
- ↑ William B. Jensen: The Origin of the Names Malic, Maleic, and Malonic Acid, in: J. Chem. Educ., 2007, 84, S. 924, doi:10.1021/ed084p924.
