Technetium
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Technetium, Tc, 43 | |||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | |||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 7, 5, d | |||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig grau metallisch | |||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-136-0 | |||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.305 | |||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 1,2 · 10−15 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||
| Atomar[2] | ||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 98,9063 u | |||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 135 (185) pm | |||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 147 pm | |||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d5 5s2 | |||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 7.11938(3) eV[3] ≈ 686.92 kJ/mol[4] | |||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 15.26 eV[3] ≈ 1472 kJ/mol[4] | |||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 29.55 eV[3] ≈ 2851 kJ/mol[4] | |||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 41.0(1,7) eV[3] ≈ 3956 kJ/mol[4] | |||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 57.0(1,9) eV[3] ≈ 5500 kJ/mol[4] | |||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[2] | ||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 11,5 g/cm3 (25 °C)[5] | |||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 3,9 · 10−4)[6] | |||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 2430 K (2157 °C) | |||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 4538 K (4265 °C) | |||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 8,63 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 550 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 23 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 4,54 · 106 S·m−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 51 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[2] | ||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −3 bis +7 | |||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,272 V (TcO2 + 4 e− + 4 H+ → Tc + 2 H2O) | |||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,9 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||
 Radioaktiv | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||
Technetium ist ein chemisches Element mit dem Elementsymbol Tc und der Ordnungszahl 43. Es kommt auf der Erde natürlicherweise vor, wenn auch in sehr geringen Mengen. Technetium war das erste künstlich hergestellte Element und erhielt deswegen seinen aus dem altgriechischen Wort τεχνητός technētós („künstlich“, Ableitung von τέχνη téchne) hergeleiteten Namen.
Es zählt zu den Übergangsmetallen, im Periodensystem steht es in der 5. Periode und der 7. Nebengruppe (Gruppe 7) oder Mangangruppe.
Alle Technetium-Isotope sind radioaktiv, das heißt, sämtliche Atomkerne, die 43 Protonen enthalten, sind instabil und zerfallen. Technetium und das schwerere Promethium (61) sind die einzigen Elemente mit kleinerer Ordnungszahl als Bismut (83), die diese Eigenschaft besitzen.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Viele Jahre gab es in dem von dem russischen Chemiker Dmitri Mendelejew vorgeschlagenen Periodensystem der Elemente eine Lücke zwischen den Elementen Molybdän (42) und Ruthenium (44), die auf ein bisher unidentifiziertes Element hinwies. Mendelejew selbst gab ihm den Namen Eka-Mangan (zusammengesetzt aus Sanskrit एक eka für „eins“ und Mangan, entsprechend seiner Position im Periodensystem „eine Zeile unterhalb von Mangan“) und sagte mit guter Näherung unter anderem seine Masse voraus. In der Folgezeit versuchten zahlreiche Forscher, das fehlende Element zu entdecken; seine Position im Periodensystem stärkte die Annahme, dass es leichter zu finden sei als andere, noch unentdeckte Elemente mit höheren Ordnungszahlen.

Fehlgeschlagene Entdeckungen
[Bearbeiten | Quelltext bearbeiten]Die Anzahl der vermeintlichen Nachweise des Elements sowie der mit dem Element in Verbindung gebrachten Entdeckungen ist ungewöhnlich groß. Dies ist darauf zurückzuführen, dass Tc als Radioelement in der Natur nur in extrem niedrigen Konzentrationen vorliegt. Die erste vermeintliche Entdeckung, die mit Technetium in Verbindung gebracht wurde, ist die von Polinium 1828 durch Gottfried Osann. Dieser meinte, neben der tatsächlichen Entdeckung des Rutheniums, auch ein Element entdeckt zu haben, das er Polinium nannte. Es stellte sich allerdings bald heraus, dass es sich bei dem Fund um unreines Iridium handelte. Aufgrund der Lage im damals noch nicht vollständig bekannten Periodensystem wurde die Entdeckung mit Technetium in Verbindung gebracht.[8][9]
Das nächste vermeintliche Element, das für das spätere Technetium gehalten wurde, war das 1846 entdeckte Ilmenium. Über dieses, angeblich dem Niob und Tantal ähnliche Element (wahrscheinlich war es unreines Niob) wurde von seinem Entdecker Hans Rudolph Hermann[10] 30 Jahre nach der Entdeckung und unter Einbeziehung des inzwischen etablierten Periodensystems behauptet, es sei das fehlende Eka-Mangan. Auch das 1847 von Heinrich Rose vermeintlich gefundene Pelopium wurde für Technetium gehalten.[8][11]
Die erste Fehlentdeckung, bei der tatsächlich nach dem fehlenden Element mit der Ordnungszahl 43 gesucht wurde, war das Davyum. 1877 meldete der russische Chemiker Serge Kern die Entdeckung des fehlenden Elements in Platin-Erz und gab dem vermeintlichen Element nach dem englischen Chemiker Sir Humphry Davy den Namen Davyum.[12] Der Fund stellte sich jedoch als Mischung aus Iridium, Rhodium und Eisen heraus.
Eine weitere vermeintliche Entdeckung fand im Jahr 1896 mit Lucium statt, dabei handelte es sich jedoch um Yttrium. Schließlich schloss der japanische Chemiker Masataka Ogawa aus der Analyse eines Minerals auf die Anwesenheit von Nipponium (benannt nach Nippon, dem japanischen Wort für Japan), das er für das Element mit der Ordnungszahl 43 hielt.[13] Spätere Analysen deuteten stattdessen auf Rhenium hin.[8]
Irrtümlicher Nachweis durch Noddack, Tacke und Berg
[Bearbeiten | Quelltext bearbeiten]Die deutschen Chemiker Walter Noddack, Ida Tacke und Otto Berg berichteten im Jahr 1925 von der Entdeckung des Elements 43 und gaben ihm den Namen Masurium, abgeleitet von Masuren, der Heimat von Walter Noddack.[14][15] Die Gruppe beschoss an der Physikalisch-Technischen Reichsanstalt Berlin das Mineral Columbit mit einem Elektronenstrahl und schloss aus den Röntgenspektren auf die Anwesenheit von Element 43. Das beobachtete Signal war jedoch nahe an der Nachweisgrenze und konnte von anderen Arbeitsgruppen zu dieser Zeit nicht reproduziert werden. Eine präparative Reindarstellung gelang – im Einklang mit der Mattauchschen Isobarenregel – nicht. Die Entdeckung wurde deshalb nicht anerkannt.[16][17] Noch im Jahr 1933 verwendeten etliche Artikel über die Entdeckung der Elemente den Namen Masurium (Symbol: Ma) für das Element 43.[18]
In den Jahren zwischen 1988 und 2005 wurde die Zurückweisung der Entdeckung wiederholt in Frage gestellt. Der Physiker van Assche nahm zunächst eine Revision der originalen Photoplatte der Noddacks vor und kam zu dem Schluss, dass 1925 tatsächlich ein Nachweis natürlich vorkommenden Technetiums aus der Spontanspaltung von 238U (die Hauptquelle der geringen Mengen natürlich auf Erden vorkommenden Technetiums) gelungen sein könnte.[19] John T. Armstrong vom US-amerikanischen National Institute of Standards and Technology simulierte später die Experimente mit einem Computer und kam zu vergleichbaren Resultaten wie Noddack, Berg und Tacke. Unterstützung kam durch eine Arbeit von David Curtis vom Los Alamos National Laboratory, der das sehr geringe natürliche Vorkommen von Technetium mit den Methoden von Noddack, Tacke und Berg nachwies. Die Debatte über die umstrittene Erstentdeckung schien daher kurzzeitig wieder offen.[16][20] Wenig später wurde der bis dahin jüngste Bericht über eine „Rehabilitierung“ jedoch wieder zurückgenommen und die neuerlichen Irrtümer klar benannt.[21] Es war inzwischen klar geworden, dass die Nachweisgrenze der röntgenanalytischen Methode der Noddacks nicht ausreichte, um natürlich vorkommende Technetium-Spuren zu erfassen.[22][23]
Nachweis durch Segrè und Perrier
[Bearbeiten | Quelltext bearbeiten]
1937, 66 Jahre nachdem Dmitri Mendelejew viele der Eigenschaften des Technetiums vorhergesagt hatte, wurde das Element schließlich auf unumstrittene Weise nachgewiesen. Emilio Segrè und Carlo Perrier, beide an der Universität Palermo tätig, isolierten das neue Element aus einer mit Deuteronen bombardierten Molybdänfolie, die Segrè zu Anfang des Jahres von Ernest Lawrence von der University of California, Berkeley, USA, erhalten hatte:
- Molybdän wird mit Deuteronen unter Neutronenemission zu Technetium umgesetzt.
Segrè und Perrier benannten das erste künstlich hergestellte Element nach dem griechischen Wort τεχνητός (Transkription technētós) für „künstlich“ als Technetium[24][25] und gingen damit nicht auf Wünsche von Verantwortlichen der Universität Palermo ein, die nach dem lateinischen Wort für Palermo, Panormus, stattdessen den Namen Panormium vorgeschlagen hatten.[9][15]
Nuklearmedizinische Anwendungen
[Bearbeiten | Quelltext bearbeiten]Powell Richards veröffentlichte im Juni 1960 die erste Studie zur Anwendung des Kernisomers 99mTc (Halbwertszeit 6 h) in der Nuklearmedizin. 99mTc wird mittels Technetium-99m-Generatoren aus dem stabileren 99Mo (Halbwertszeit 66 h) gewonnen. Die erste Methode zur wirtschaftlichen Trennung von 99Mo und 99mTc wurde in den 1960er-Jahren von den US-amerikanischen Forschern Walter Tucker und Margaret Green am Brookhaven National Laboratory entwickelt.
Der Forschungsreaktor FRM II in München stellt mit der Bestrahlung von Uranplättchen einen signifikanten Anteil des weltweiten Verbrauchs von Molybdän Mo-99 als Vorprodukt für Technetium-99 her. Seit 2015 deckt FRM II den deutschen Bedarf (etwa 10 % der weltweiten Produktion), seit 2019 etwa 50 % des europäischen Bedarfs. Weitere Reaktoren und Anlagen sind in Frankreich, in den Niederlanden, in Belgien und in Kanada im Einsatz. Neue Einrichtungen werden hier nötig, nachdem diese Anlagen ihre Lebensdauer überschritten haben bzw. haben werden.[26][27][28]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Außerirdisches Vorkommen
[Bearbeiten | Quelltext bearbeiten]1952 wies der US-amerikanische Astronom Paul Willard Merrill auf spektroskopische Weise in Roten Riesensternen der S-; M- und N-Klasse größere Mengen Technetium nach.[29] Weil diese Sterne am Ende ihrer Entwicklung stehen und dementsprechend alt sind, die längste Halbwertszeit eines Technetium-Isotops aber nur wenig mehr als 4 Millionen Jahre beträgt, war dies der erste eindeutige Beweis dafür, dass Technetium und andere schwere Elemente durch Kernfusion im Inneren von Sternen entstehen. Bei Hauptreihensternen wie der Sonne ist die Temperatur im Sterninneren allerdings nicht hoch genug für die Synthese von Elementen schwerer als Eisen. Bedingungen, wie sie im Inneren von Roten Riesen herrschen, sind für die Technetium-Synthese daher unerlässlich.[30][31][32]
Irdisches Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Seit man die Existenz eines Elements mit der Ordnungszahl 43 angenommen hatte, wurde auf der Erde nach natürlichen Vorkommen gesucht. Erst 1961 gelang es, aus 5,3 kg Pechblende aus Katanga in Afrika ungefähr 1 ng Technetium zu isolieren und spektrografisch nachzuweisen.[30] Aus der Spontanspaltung von 238U-Kernen entsteht dabei unter anderem Technetium. Dadurch enthält 1 kg Natururan ca. 1 ng Technetium.[24][33][34]
Alles auf der Erde natürlich vorhandene Technetium ist ein temporäres Zwischenprodukt des nuklearen Zerfalls schwerer Atomkerne und zerfällt nach einiger Zeit selbst wieder. Das Vorkommen dieses Elements auf der Erde ist daher nicht mit dem eines stabilen Elements gleichzusetzen. Insgesamt liegt der Technetium-Gehalt der Erdkruste nur wenig höher als der des Franciums und Astats, beides ebenfalls radioaktive Elemente, die nur im Mikrogramm-Maßstab auf der Erde vorhanden sind. Die Technetium-Konzentration war vor etwa zwei Milliarden Jahren beim Naturreaktor Oklo erhöht, da dort eine sich selbst erhaltende Kernspaltungs-Kettenreaktion ablief. Nachzuweisen ist dies heute durch den erhöhten Anteil von 99Ru; jenem Ruthenium-Isotop, das beim Zerfall von Technetium-99 entsteht.[35] Bei etwa 6 % der Spaltungen von 235U entstehen Tc-99-Atomkerne bzw. dessen kurzlebige Mutternuklide.[36]
In der Biosphäre kommt Technetium ausschließlich als Resultat menschlicher Aktivitäten vor.[37] Bei oberirdischen Kernwaffentests wurden bis 1994 etwa 250 kg Technetium in der Atmosphäre erzeugt, dazu kommen etwa 1600 kg, die bis 1986 weltweit aus Wiederaufarbeitungsanlagen und Kernreaktoren freigesetzt wurden.[37] Allein aus der Anlage im britischen Sellafield wurden von 1995 bis 1999 etwa 900 kg des Metalls in die Irische See eingeleitet, seit dem Jahr 2000 ist die gesetzlich erlaubte Eintragsmenge allerdings auf 140 kg pro Jahr begrenzt.[38]
In Lebewesen lässt sich Technetium nur in Ausnahmefällen nachweisen, etwa bei Hummern der stark belasteten Irischen See.[39] Im menschlichen Körper findet es sich in der Regel nur bei Patienten, die sich einer technetiumbasierten nuklearmedizinischen Anwendung unterzogen haben. Da diese den Großteil des Technetiums früher oder später wieder ausscheiden, gelangt auf diesem Weg ebenfalls Technetium in die Biosphäre.
Gewinnung und Entsorgung
[Bearbeiten | Quelltext bearbeiten]Für medizinische Zwecke wird Technetium meist durch Kernspaltung oder Neutronenbeschuss von 98Mo gewonnen:
Die 99Mo-Kerne zerfallen unter Aussendung von Betastrahlung mit einer Halbwertszeit von 2 Tagen und 19 Stunden in angeregte (metastabile oder isomere) 99mTc-Kerne:
In der Praxis ist Molybdän nicht als Element, sondern in Form seines an Aluminiumoxidsäulen adsorbierten Salzes Molybdat (MoO42−) der Ausgangsstoff der Technetium-Gewinnung, so dass nicht elementares Technetium, sondern das Pertechnetat-Ion (TcO4−) entsteht und zwar in typischen Konzentrationen von zwischen 10−6 und 10−8 Mol pro Liter. Dieses wird an seinem Einsatzort zunächst von dem verbliebenen Molybdat getrennt, bevor es in Gegenwart geeigneter Liganden, organischer Substanzen, die sich mit Technetium zu Komplexen verbinden, durch Wasserstoffgas H2 zum reinen Element reduziert werden kann. Das solcherart komplexgebundene metastabile Isotop 99mTc geht mit einer Halbwertszeit von nur sechs Stunden durch Aussendung von Gammastrahlung in den Grundzustand 99Tc über:
Es ist diese Strahlung, die in der medizinischen Diagnostik genutzt wird.
Daneben entstehen pro Jahr in Kernreaktoren mehrere Tonnen Technetium aus der Spaltung des Uranisotops 235U; sie haben an allen Spaltprodukten eines abgebrannten Brennelements einen Anteil von etwa 6 %. Die bis zu Beginn des 21. Jahrhunderts künstlich hergestellte Gesamtmenge des Metalls liegt bei mehr als 78 Tonnen[37] und damit weit über den natürlichen Technetiumvorkommen.
Der größte Teil des reaktorproduzierten Metalls bildet nur unerwünschten radioaktiven Abfall. Bei seiner Lagerung muss das mit einer Halbwertszeit von mehr als 200.000 Jahren recht langlebige Isotop 99Tc berücksichtigt werden, das in der Zeit zwischen etwa 10.000 und etwa 1.000.000 Jahren nach seiner Erzeugung die dominante Strahlungsquelle darstellt.[37] Zur Entsorgung werden in erster Linie als stabil angesehene geologische Formationen wie Salzstöcke in Betracht gezogen; Kritiker äußern allerdings die Befürchtung, dass das Element dennoch durch Wasser in die Umgebung ausgewaschen werden könnte. Daneben wird auch die Möglichkeit der Transmutation, der Umwandlung des Metalls in andere Elemente – zum Beispiel durch Neutronenbeschuss, erwogen. Technetium-99 kann durch Neutroneneinfang in das kurzlebige Tc-100 umgewandelt werden, welches mit wenigen Minuten Halbwertszeit zu stabilem Ruthenium-100 zerfällt. Obwohl das Verfahren im Labormaßstab bereits erfolgreich durchgeführt werden konnte und obwohl Ruthenium ein wertvolles Edelmetall ist, sind die Energiemengen, welche zur Erzeugung von Neutronen benötigt werden, ein Hindernis.[40][41]
Zur kommerziellen Verwendung wird Technetium im Kilogramm-Maßstab in Wiederaufarbeitungsanlagen aus abgebrannten Nuklearbrennstäben gewonnen. Dazu wird es zunächst zu Pertechnetat TcO4− oxidiert und dann nach einer Abklingzeit von mehreren Jahren in gelöster Form durch Extraktion und Ionenaustauschverfahren von Uran-, Plutonium- und anderen Verbindungen getrennt. Die Produkte Ammoniumpertechnetat NH4TcO4 oder auch Ammoniumtechnetiumhexachlorid (NH4)2TcCl6 können dann bei hohen Temperaturen durch thermische Zersetzung in Wasserstoffgas H2 zu elementarem Technetium reduziert werden. Alternativ kann das Metall durch Elektrolyse von Ammoniumpertechnetat in mit Wasserstoffperoxid (H2O2) angereicherter Schwefelsäure (H2SO4) gewonnen werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Technetium ist ein radioaktives Metall, das in der häufigen Pulverform mattgrau erscheint. Als makroskopischer Festkörper hat es dagegen eine silbergraue Farbe und ähnelt dadurch dem Element Platin.[31] Charakteristische Spektrallinien der Technetiumatome liegen bei 363, 403, 410, 426, 430 und 485 Nanometern.[42]
Sowohl der Schmelz- als auch der Siedepunkt von jeweils 2157 und 4265 °C liegen zwischen den entsprechenden Werten der Gruppennachbarn Mangan und Rhenium. Das reine Massenmetall kristallisiert im hexagonalen Kristallsystem (hexagonal-dichteste Kugelpackung, Magnesium-Typ) in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 275,3 pm und c = 440 pm sowie zwei Formeleinheiten pro Elementarzelle.[43] Die Kristallstruktur des nanodispersen Reinmetalls ist kubisch. Nanodisperses Technetium hat kein geteiltes NMR-Spektrum,[44] während hexagonales Bulk-Technetium das Tc-99-NMR-Spektrum in 9 Satelliten geteilt hat.[45][46]
Metallisches Technetium ist leicht paramagnetisch, das heißt, seine magnetische Suszeptibilität χm ist positiv, die magnetischen Dipole im Inneren des Materials richten sich parallel zu einem externen Magnetfeld aus und die Substanz wird in selbiges hineingezogen.[47] Bei Temperaturen unterhalb von 7,7 Kelvin ist das reine Element ein Supraleiter 2. Art, verliert also seinen elektrischen Widerstand; schon kleinste Verunreinigungen heben diese Temperatur allerdings auf 11,2 Kelvin an. Die Eindringtiefe magnetischer Felder im supraleitenden Zustand ist für Technetium nach Niob die zweitgrößte aller Metalle.[48] Kernspinresonanz-Untersuchungen mit Technetium sind aufgrund der hohen Empfindlichkeit des Isotops 99Tc möglich.[49] Die Elementarzellenparameter des orthorhombischen Tc-Metalls wurden angegeben, wenn Tc mit Kohlenstoff verunreinigt ist (a = 0,2805(4), b = 0,4958(8), c = 0,4474(5)·nm für Tc-C mit 1,38 Gew.-% C und a = 0,2815(4), b = 0,4963(8), c = 0,4482(5) •nm für Tc-C mit 1,96 Gew.-% C).[50]
Bei Temperaturen unter 8,2 K wird Technetium supraleitend. Hinter Niob ist Technetium damit das Element mit der zweithöchsten Sprungtemperatur bei Normaldruck.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Technetium liegt im Periodensystem in seiner Gruppe zwischen den beiden Elementen Mangan und Rhenium, ähnelt in seinen chemischen Eigenschaften jedoch nur dem letzteren.
Das Technetium-Atom besitzt sieben Valenzelektronen, zwei davon im 5s-Orbital, die restlichen fünf im 4d-Orbital, die maximale Oxidationsstufe beträgt daher +VII. Die ersten drei Ionisierungsenergien von 702, 1472 und 2850 kJ/mol liegen allesamt unter den entsprechenden Werten des leichteren Gruppennachbarn Mangan, was sich qualitativ auf den größeren Abstand der Valenzelektronen zum Kern und ihre dadurch verminderte elektrische Wechselwirkungsenergie zurückführen lässt. Insbesondere ist die Differenz zwischen zweiter und dritter Ionisationsenergie von 1378 kJ/mol bedeutend geringer als die des Mangans von 1739 kJ/mol. Anders als dieses Element, dessen Chemie daher im Wesentlichen die des zweifach positiv geladenen Mn2+-Ions ist, findet man Technetium häufig in anderen Oxidationsstufen.[51] Die wichtigsten sind +IV, +V und +VII, daneben findet man Verbindungen, in denen Technetium die Oxidationszahlen −I, 0, +I, +III oder +VI einnimmt, während der für Mangan so charakteristische +II-Zustand nur selten auftritt.[47]
In feuchter Luft läuft das Metall durch Oxidation langsam an. Technetium bildet die einfachen Kohlenstoffinsertionsphasen mit niedrigem Kohlenstoffgehalt von bis zu 17 Atom-% C, wenn es mit Graphit reagiert[52] oder durch Thermolyse organischer Pertechnetate[53]. Tc gilt als das letzte D-Element, das eine geringe, aber bemerkenswerte Affinität zu Kohlenstoff aufweist.[54]
Die Pulverform ist nicht nur brennbar, sondern allgemein reaktiver und verbindet sich heftig mit Halogenen. Technetium löst sich nur in oxidierenden Säuren wie konzentrierter Schwefelsäure (H2SO4) oder Salpetersäure (HNO3), nicht jedoch in Salzsäure (HCl(aq)) oder Flusssäure (HF(aq)); in gasförmigem Chlor- und Fluorwasserstoff ist das Metall beständig.[31]
Isotope
[Bearbeiten | Quelltext bearbeiten]Von Technetium sind bisher 34 Isotope bekannt, deren Massenzahlen zwischen 85 und 118 liegen. Das langlebigste davon ist mit einer Halbwertszeit von 4,2 Millionen Jahren 98Tc, gefolgt von 97Tc mit einer Halbwertszeit von 2,6 Millionen Jahren und 99Tc mit einer Halbwertszeit von 211.100 Jahren. Letzteres ist zugleich das häufigste und ökonomisch wichtigste Isotop und setzt mit einer Aktivität von 620 Millionen Becquerel pro Gramm eine weiche Betastrahlung der Energie 293,6 Kiloelektronenvolt (keV) frei.
Der Zerfallsmechanismus bei den Isotopen mit Massenzahlen unterhalb von 98 ist der Elektroneneinfang, so dass Molybdän-Isotope entstehen; bei schwereren Technetium-Isotopen kommt es dagegen zum Betazerfall und zur Bildung von Ruthenium-Isotopen. Eine Ausnahme stellt lediglich 100Tc dar, das über beide Zerfallswege in ein anderes Element übergehen kann.[55][56]
Neben den durch ihre Neutronenzahl unterschiedenen Isotopen existiert eine Reihe angeregter, metastabiler Zustände wie 95mTc, 97mTc und 99mTc, die mit Halbwertszeiten von (in dieser Reihenfolge) 61 Tagen, 90 Tagen und 6,01 Stunden in den zugehörigen Grundzustand übergehen. Das wichtigste metastabile Isotop ist 99mTc, das eine große Rolle in der Nuklearmedizin spielt.[47][55]
Die Instabilität des Technetiums lässt sich kernphysikalisch damit erklären, dass seine Ordnungszahl ungerade ist und die benachbarten Elemente Molybdän und Ruthenium sehr viele stabile Isotope haben (Mattauchsche Isobarenregel).
Verwendung
[Bearbeiten | Quelltext bearbeiten]

Nur geringe Mengen Technetium werden wirtschaftlich genutzt; der größte Anteil kommt in der Medizin als Bestandteil von Radiopharmaka zur Anwendung,[57] es findet jedoch auch als Korrosionsschutz und als Betastrahlenquelle Verwendung.
Nuklearmedizin
[Bearbeiten | Quelltext bearbeiten]Metastabiles 99mTc ist aufgrund seiner kurzen Halbwertszeit, der emittierten Gammastrahlung mit einer Energie von 140 keV und seiner Fähigkeit, sich an viele aktive Biomoleküle anzulagern, das bei weitem wichtigste, als Tracer für szintigrafische, also bildererstellende nuklearmedizinische Untersuchungen[24] eingesetzte Nuklid. Dazu werden organische Liganden mit einer hohen Neigung, sich an Zellen des zu untersuchenden Organs zu binden, oder monoklonale Antikörper, Proteine des Immunsystems, die sich an ausgewählte Antigene von Tumorzellen heften, an Technetium gekoppelt und intravenös in den Blutkreislauf des Patienten gespritzt. Das Metall konzentriert sich auf diese Weise in den gewünschten Organen und Geweben oder dem zu untersuchenden Tumor; die charakteristische Gammastrahlung kann dann durch mit Thallium dotierte Natriumiodid-Detektoren registriert und zur nicht-invasiven Diagnose, etwa des durch die Antikörper markierten Tumors, herangezogen werden. Auf diese Weise können das Gehirn, die Schilddrüse, die Lungen, die Leber, die Gallenblase, die Milz, die Nieren, Knochengewebe, aber auch schwer zugängliche Teile des Darms untersucht werden.[58] Die Kopplung von Technetium-Zinn-Verbindungen an Erythrozyten, die roten Blutkörperchen, ermöglicht eine Diagnose von Erkrankungen des Blutgefäßsystems; Bindung von Technetium-Pyrophosphaten an Calciumablagerungen des Herzmuskelgewebes wird bei der Diagnose von Herzinfarkt-Patienten eingesetzt.[59]
Die von 99mTc emittierte energiereiche Gammastrahlung ermöglicht eine niedrige Dosierung. Nach der Untersuchung wird der größte Teil des bei einer nuklearmedizinischen Diagnose aufgenommenen Technetiums wieder ausgeschieden. Das verbliebene 99mTc zerfällt schnell in 99Tc. Dieses besitzt eine lange Halbwertszeit von 212.000 Jahren und trägt wegen der relativ weichen Betastrahlung, die bei seinem Zerfall frei wird, nur zu einer geringen zusätzlichen Strahlenbelastung über die restliche Lebenszeit bei.[59] In den USA werden für Diagnose-Zwecke pro Jahr etwa sieben Millionen Einzeldosen 99mTc verabreicht.
Technetium für nuklearmedizinische Zwecke wird – aufgrund der kurzen 6-Stunden-Halbwertszeit – in der Regel aus Technetium-99m-Generatoren gewonnen.[60] Allerdings gibt es auf der Welt nur fünf Reaktoren, in denen Molybdän-99 als Mutternuklid des Technetium-99 gewonnen wird (drei in Europa, einer in Südafrika und einer in Kanada). Im Jahr 2010 wurde berichtet, dass es wegen des großen Alters der meisten dieser Reaktoren und der damit verbundenen technischen Probleme zu mehreren Ausfällen einiger Reaktoren gekommen sei, was die Produktion von Technetium stark einschränkte. Man befürchtete, dass es infolge dieser Reaktorprobleme bald zu einer gravierenden Verknappung des für die Tumordiagnose wichtigen Isotops kommen könne.[61][62]
Sonstige Anwendungen
[Bearbeiten | Quelltext bearbeiten]Das nicht-angeregte Isotop 99Tc selbst wird als wirtschaftlich gut nutzbare Quelle für Betastrahlen eingesetzt. Es bietet den Vorteil, dass bei seinem Zerfall keinerlei Gammastrahlung auftritt, so dass nur relativ geringe Sicherheitsvorkehrungen notwendig sind.
Daneben ist Technetium in Form seiner Salze eines der besten Rostschutzmittel: Ammonium- oder Kaliumpertechnetat könnte als Korrosionsschutz für Stahl Anwendung finden. Ein Zusatz von 55 ppm (Millionstel Teilen) Kaliumpertechnetat (KTcO4) in belüftetem entionisiertem Wasser schützt dieses Material bis zu einer Temperatur von 250 °C vor Korrosion.[63] Wegen der Radioaktivität von Technetium ist eine potentielle Anwendung allerdings auf von der Umwelt abgeschlossene Systeme wie etwa Siedewasserreaktoren beschränkt.[64]
Pertechnetate dienen als wichtige Ausgangsstoffe der Technetiumchemie und spielen auch als Katalysatoren in der anorganischen Chemie eine gewisse Rolle.[65]
Verbindungen und Reaktionen
[Bearbeiten | Quelltext bearbeiten]→ Kategorie:Technetiumverbindung
Technetium bildet im Gegensatz zu Mangan kaum Kationen. Es ähnelt darin, wie auch in seiner geringeren Reaktivität und in der Fähigkeit, kovalente Bindungen einzugehen, seinem anderen Gruppennachbarn Rhenium. Im Gegensatz zu diesem sind die hohen Oxidationszustände allerdings etwas unbeständiger gegenüber Reduktion, dem Übergang in einen niedrigeren Oxidationszustand durch (formale) Aufnahme von Elektronen.
Hydridokomplex
[Bearbeiten | Quelltext bearbeiten]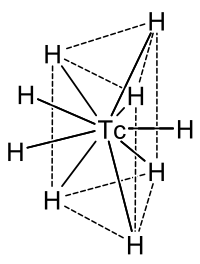
Bei der Reaktion von Technetium mit Wasserstoff entsteht der anionische, also negativ geladene Hydridokomplex [TcH9]2−, dessen zentrales Technetiumatom wie nebenstehend zu sehen in einem trigonalen Prisma aus Wasserstoffatomen liegt; lotrecht über dem Mittelpunkt der drei Seitenflächen befindet sich zudem je ein weiteres Wasserstoffatom. Der Ladungsausgleich kann zum Beispiel durch je zwei Natrium- (Na+) oder Kalium-Ionen (K+) erfolgen.[66] Auch über die Synthese von Technetiumhydrid TcH1,3 bei 27 GPa wird berichtet.[67]
Oxide
[Bearbeiten | Quelltext bearbeiten]Es existieren zwei verschiedene Technetiumoxide (TcO2 und Tc2O7). Bei Temperaturen von etwa 400–450 °C reagiert das Metall direkt mit Sauerstoff zu blassgelbem Ditechnetiumheptoxid:
Das Molekül besteht aus zwei über ein Sauerstoffatom miteinander verbundenen Technetiumatomen, die ihrerseits durch je drei Doppelbindungen an die verbleibenden Sauerstoffatome gebunden sind und ist das Anhydrid der Pertechnetiumsäure HTcO4, die sich bei Lösung des Oxids in Wasser bildet.[68][69]
Das schwarze Technetiumdioxid (TcO2) lässt sich durch Reduktion von Ditechnetiumheptoxid mit elementarem Technetium oder Wasserstoff darstellen.[70]
Pertechnetiumsäure
[Bearbeiten | Quelltext bearbeiten]Pertechnetiumsäure (HTcO4) bildet sich, wenn Technetiumheptoxid in Wasser oder Technetium in oxidierenden Säuren wie Salpetersäure, konzentrierter Schwefelsäure oder Königswasser, einem Salpetersäure-Salzsäure-Gemisch, gelöst wird. Die dunkelrote, wasseranziehende (hygroskopische) Substanz zählt zu den starken Säuren und liegt in Wasser stark dissoziiert vor, das Proton ist also fast immer auf ein Wassermolekül übertragen. In den letzten 70 Jahren wurde angenommen, dass die Säure in ihrer freien Form dunkelrot ist[71], fast braune Kristalle, die in einem wässrigen Medium gut löslich sind. Diese Eigenschaften sorgten bei den meisten Chemikern, die mit Technetinsäure arbeiteten, für Verwirrung. Im Jahr 2021 wurde dieses Rätsel gelüftet – tatsächlich wird Tc(VII) in diesem System teilweise instabil, und im Prozess der teilweisen Reduktion entsteht[72] [H7O3]4[Tc20O68]·4H2O aus Technetinsäure, die dennoch stark saure Eigenschaften besitzt. Das entsprechende Ammoniumpolyoxotechnetatsalz wurde kürzlich aus Trifluormethansulfonsäure isoliert und hat eine sehr ähnliche Struktur.[73]
Das verbliebene Pertechnetat-Anion TcO4− besteht aus einem Technetium-Atom, das im Zentrum eines Tetraeders liegt, an dessen vier Ecken die Sauerstoffatome sitzen. Es ist im Gegensatz zum Permanganat-Ion MnO4− verhältnismäßig reduktionsstabil, so dass die farblosen Salze wie Kalium- (KTcO4) oder Ammoniumpertechnetat (NH4TcO4) nur relativ schwache Oxidationsmittel sind. Natrium-, Magnesium- und Calciumpertechnetat sind gut, Barium- und Ammoniumpertechnetat moderat, Kalium- sowie Thalliumpertechnetat dagegen nur geringfügig wasserlöslich.
Durch Reduktionsmittel kann Pertechnetat zum Technetat [TcO4]2− (purpurfarben) reduziert werden.[74]
Halogenide und Oxidhalogenide
[Bearbeiten | Quelltext bearbeiten]Neben den Technetiumhalogeniden, in denen Technetium an Halogenatome gebunden ist, sind zahlreiche Technetiumoxidhalogenide bekannt, in denen neben den Halogenatomen zusätzlich noch Sauerstoff gebunden ist.
Durch direkte Reaktion der Ausgangsstoffe entstehen die beiden Fluor-Verbindungen, das gelbe Technetiumpentafluorid (TcF5) und das gleichfarbige Technetiumhexafluorid (TcF6). Ebenfalls direkt synthetisieren lassen sich die beiden Chlor-Verbindungen, das grüne Technetiumhexachlorid (TcCl6) und das rote Technetiumtetrachlorid (TcCl4). Letzteres ist paramagnetisch und liegt in polymerisierter Form, also als Kette aneinandergereihter TcCl4-Untereinheiten vor und lässt sich auch durch Reaktion von Technetiumheptoxid (Tc2O7) mit Tetrachlormethan (CCl4) darstellen. Wichtige Technetiumhalogenid-Salze werden von den beiden Anionen [Tc2Cl8]2−, [Tc2Cl8]3− und [Tc6Cl14]3−gebildet.[75] Die wichtigste Bromverbindung ist das rotbraune Technetiumtetrabromid TcBr4, daneben existiert das Anion [Tc2Br8]3− und [Tc8Br4(μ-Br)8]Br3−.[75]
Die Technetiumoxidhalogenide sind für Fluor die Verbindungen Technetiumfluoridtrioxid TcO3F, Technetiumtrifluoriddioxid TcO2F3, Technetiumpentafluoridoxid TcOF5 und Technetiumtetrafluoridoxid TcOF4, in denen das Metall in den Oxidationsstufen +VII und +VI auftritt, für Chlor die Verbindungen Technetiumchloridtrioxid TcO3Cl, Technetiumtetrachloridoxid TcOCl4 und Technetiumtrichloridoxid TcOCl3 mit den Oxidationsstufen +VII, +VI und +V und für Brom und Iod die einander analogen Verbindungen Technetiumbromidtrioxid TcO3Br und Technetiumiodidtrioxid TcO3I. Bei letzteren Substanzen nimmt das zentrale Technetiumatom die maximale Oxidationszahl +VII an. Technetiumtrifluoriddioxid TcO2F3 liegt ebenso wie Technetiumtrichloridoxid TcOCl3 und Technetiumtribromidoxid TcOBr3 in polymerisierter Form vor.
Alle Halogen-Sauerstoff-Verbindungen des Technetiums zersetzen sich bei Kontakt mit Wasser leicht zu Pertechnetat und Technetiumdioxid. Insbesondere hoch fluorierte Verbindungen wie Technetiumpentafluoridoxid TcOF5 lassen sich nur durch starke Fluorierungsmittel wie Xenonhexafluorid XeF6 oder Kryptondifluorid KrF2 darstellen, wie die folgenden Reaktionsschritte exemplarisch zeigen:
- Ditechnetiumheptoxid reagiert mit Fluorwasserstoff zu Technetiumfluoridtrioxid, Oxoniumionen und Hydrogendifluorid(-1).
- Technetiumfluoridtrioxid reagiert mit Xenonhexafluorid zu Technetiumtrifluoriddioxid und Xenontetrafluoridoxid.
- Technetiumtrifluoriddioxid reagiert mit Kryptondifluorid zu Technetiumpentafluoridoxid, elementarem Krypton und Sauerstoff.
Sulfide, Selenide, Telluride
[Bearbeiten | Quelltext bearbeiten]Mit Schwefel bildet Technetium zwei verschiedene Sulfide. Während Technetiumdisulfid TcS2 durch direkte Reaktion der Ausgangsstoffe entsteht, kann das schwarze Ditechnetiumheptasulfid Tc2S7 wie folgt dargestellt werden:
- Pertechnetiumsäure reagiert mit Schwefelwasserstoff zu Ditechnetiumheptasulfid und Wasser.
Technetium wird in diesem Fall nicht reduziert, anders als bei der analogen Reaktion des Mangans, bei dem sich aus MnO4− das stabile Mn2+-Ion bildet. Thermische Zersetzung des Heptasulfids führt zu einer Aufspaltung in das Disulfid und elementaren Schwefel:
Mit Selen und Tellur bildet Technetium die analogen Substanzen zu Technetiumdisulfid, also Technetiumdiselenid (TcSe2) und Technetiumditellurid (TcTe2).[76]
Cluster
[Bearbeiten | Quelltext bearbeiten]
Es existieren zwei wichtige Technetium-Cluster, der Tc6- und der Tc8-Cluster. In beiden sind jeweils zwei Technetiumatome durch eine Dreifachbindung miteinander verbunden. Diese Paare sind parallel zueinander angeordnet und senkrecht zur Ausrichtung der Dreifachbindung aneinander gebunden, so dass sich durch die Lage der Einfachbindungen für den Tc6-Cluster zwei parallele gleichseitige Dreiecke und für den Tc8-Cluster zwei parallele Quadrate ergeben. Im letzteren Fall ist je eine zusätzliche Einfachbindung entlang einer Diagonale dieser Quadrate ausgerichtet. Technetiumatome beider Cluster gehen allesamt sechs Bindungen ein; fehlende Bindungen können etwa durch Halogenatome wie Chlor oder Brom abgesättigt werden.[77]
Komplexverbindungen
[Bearbeiten | Quelltext bearbeiten]
Tc2(CO)10
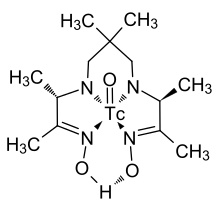
Technetium ist Bestandteil zahlreicher Komplexverbindungen, die aufgrund der Bedeutung des Elements für die Nuklearmedizin verhältnismäßig gut erforscht sind.
Ein Beispiel ist der Technetium-Carbonyl-Komplex Tc2(CO)10, der einen weißen Feststoff bildet.[78] In ihm liegen zwei schwach aneinander gebundene Technetium-Atome vor, die wie nebenstehend zu sehen in Oktaeder-Symmetrie von je fünf Carbonyl-Liganden umgeben sind. Die Bindungslänge von 303 pm ist charakteristischerweise größer als der Abstand zweier benachbarter Atome im metallischen Technetium.[79][80] Isostrukturelle Komplexe, also solche von gleicher Struktur, finden sich auch bei den beiden Nachbarelementen Mangan und Rhenium.[81] Ein Technetium-Carbonyl-Komplex, in dem Technetium in der negativen Oxidationsstufe −I auftritt, ist [Tc(CO)5]−, während sich in Wasser der oktaedrische Aquakomplex [Tc(H2O)3(CO)3]+ bildet.
Ein Beispiel für einen Komplex mit einem organischen Liganden, der in bildgebenden Verfahren der Nuklearmedizin zum praktischen Einsatz kommt, ist nebenstehend angegeben und zeichnet sich durch ein im Zentrum einer Kohlenstoff-Stickstoff-Kette gelegenes und über vier Stickstoffatome angebundenes Technetiumatom aus, das durch eine Doppelbindung mit einem Sauerstoffatom gebunden ist. Diese Technetium-Sauerstoffeinheit kann in den so genannten Nitridokomplexen durch eine Technetium-Stickstoffeinheit ersetzt sein, in der eine Dreifachbindung zwischen einem Stickstoff- und einem Technetiumatom besteht.[82]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen und eine untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Vorsichtsmaßnahmen
[Bearbeiten | Quelltext bearbeiten]Technetium hat nach bisher vorliegenden Erkenntnissen nur eine geringe chemische Toxizität. Alle Isotope des Elements sind radioaktiv und müssen entsprechend ihrer Strahlungsintensität in Strahlenschutzbehältern aufbewahrt und als radioaktives Material gekennzeichnet werden. Die Betastrahlung des häufigsten Isotops, 99Tc, wird bereits durch Glas aufgehalten; die Strahlenbelastung durch die dabei als Bremsstrahlung freiwerdende weiche Röntgenstrahlung gilt als gering, wenn ein Sicherheitsabstand von 30 Zentimetern eingehalten wird. Eingeatmeter Technetium-Staub, der sich in den Lungen festsetzt, trägt hingegen zu einem höheren Risiko für Krebserkrankungen bei. Laborarbeiten müssen daher unter einer Abzugshaube stattfinden; daneben werden Augenschutz und das Tragen von Handschuhen empfohlen.[83]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Klaus Schwochau: Technetium: Chemistry and Radiopharmaceuticals. Wiley-VCH, Weinheim 2000, ISBN 3-527-29496-1.
- C. E. Housecroft, A. G. Sharpe: Inorganic Chemistry. 2. Auflage. Pewson/Prentice Hall, 2005, ISBN 0-13-039913-2, Kapitel 22.8a, S. 666.
- R. B. King (Hrsg.): Encyclopedia of Inorganic Chemistry. Band 8, Wiley, 1994, ISBN 0-471-93620-0, S. 4094.
- Eric Scerri: A tale of seven elements, Oxford University Press, Oxford, 2013
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Technetium) entnommen.
- ↑ a b c d e Eintrag zu technetium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- ↑ a b c d e Eintrag zu technetium bei WebElements, www.webelements.com, abgerufen am 11. Juni 2020.
- ↑ Norman N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1339.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-142 – 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieses Element entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c B. T. Kenna: The Search for Technetium in Nature. In: Journal of Chemical Education. 39 (2), 1962, S. 436–442; doi:10.1021/ed039p436.
- ↑ a b Norman E. Holden: History of the Origin of the Chemical Elements and Their Discoverers. Brookhaven National Laboratory; abgerufen am 5. Mai 2009.
- ↑ R. Hermann (1846): Untersuchungen russischer Mineralien (7. Fortsetzung) 28) Ueber Ilmenium, ein neues Metall, auch über Titan, Tantal und Niobium, so wie über Aeschynit, Ytteroilmenit und Columbit. Journal für Praktische Chemie 38(1) Seiten 91–123. doi:10.1002/prac.18460380112
- ↑ Frederik A. A. de Jonge, Ernest K. J. Pauwels: Technetium, the missing element. In: European Journal of Nuclear Medicine. 23 (3), 1996, S. 336–344; doi:10.1007/BF00837634.
- ↑ Serge Kern: LE NOUVEAU MÉTAL «LE DAVYUM». In: La Nature. Nr. 234, 24. November 1877, S. 401–402.
- ↑ H. K. Yoshihara: Discovery of a new element 'nipponium': re-evaluation of pioneering works of Masataka Ogawa and his son Eijiro Ogawa. In: Spectrochimica Acta Part B: Atomic Spectroscopy. 59 (8), 2004, S. 1305–1310; doi:10.1016/j.sab.2003.12.027.
- ↑ Hans Zettler: Masurium – ein Name, den keiner mehr nennt. Warum das Element 43 Technetium heißt. Rehabilitation von W. Noddack und I. Tacke. In: FAZ. 22. Februar 1989.
- ↑ a b Peter van der Krogt: Elementymology and Elements Multidict, „Technetium“. Abgerufen am 5. Mai 2009 (englisch).
- ↑ a b John T. Armstrong: Technetium. In: Chemical & Engineering News. 2003.
- ↑ Kevin A. Nies: Ida Tacke and the warfare behind the discovery of fission. 2001, abgerufen am 5. Mai 2009.
- ↑ Mary Elvira Weeks: The Discovery of the Elements, XX: Recently Discovered Elements. In: Journal of Chemical Education. 10, 1933, S. 161–170; doi:10.1021/ed010p161.
- ↑ Pieter H. M. Van Assche: The ignored discovery of the element Z = 43; Nuclear Physics A, 1988, 480 (2), S. 205–214; doi:10.1016/0375-9474(88)90393-4.
- ↑ Roberto Zingales: From Masurium to Trinacrium: The Troubled Story of Element 43. In: Journal of Chemical Education. 82, 2005, S. 221–227; doi:10.1021/ed082p221.
- ↑ Fathi Habashi: The History of Element 43—Technetium und Entgegnung von Roberto Zingales in: Journal of Chemical Education. 83, 2006, S. 213; doi:10.1021/ed083p213.1.
- ↑ P. K. Kuroda: A Note on the Discovery of Technetium; Nuclear Physics A, 1989, 503, S. 178–182; doi:10.1016/0375-9474(89)90260-1.
- ↑ Günter Herrmann: Technetium or masurium — a comment on the history of element 43; Nuclear Physics A, 1989, 505, S. 352–360; doi:10.1016/0375-9474(89)90379-5.
- ↑ a b c John Emsley: Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford University Press, New York 2001, ISBN 0-19-850340-7, S. 422–425.
- ↑ C. Perrier, E. Segrè: Technetium: The Element of Atomic Number 43. In: Nature. 159, 1947, S. 24; doi:10.1038/159024a0.
- ↑ deutschlandfunk.de: Technetium-99 wird knapp. Abgerufen am 7. August 2022.
- ↑ Molybdän-99. Abgerufen am 7. August 2022.
- ↑ deutschlandfunk.de: Technetium-99m - Neue Anlage für ein radioaktives Kontrastmittel. Abgerufen am 7. August 2022.
- ↑ S. Paul, W. Merrill: Spectroscopic Observations of Stars of Class S. In: The Astrophysical Journal. 116, 1952, S. 21–26; doi:10.1086/145589.
- ↑ a b K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, S. 7–9.
- ↑ a b c David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-35.
- ↑ Charlotte E. Moore: Technetium in the Sun. In: Science. 114, Nr. 2951, 1951, S. 59–61; doi:10.1126/science.114.2951.59; PMID 17782983.
- ↑ Paul Dixon, David B. Curtis, John Musgrave, Fred Roensch, Jeff Roach, Don Rokop: Analysis of Naturally Produced Technetium and Plutonium in Geologic Materials. In: Analytical Chemistry. 69 (9), 1997, S. 1692–1699; doi:10.1021/ac961159q.
- ↑ D. Curtis: Nature’s uncommon elements: plutonium and technetium. In: Geochimica et Cosmochimica Acta. 63 (2), 1999, S. 275–285; doi:10.1016/S0016-7037(98)00282-8.
- ↑ H. Hidaka, N. Kano, A. Masuda: Estimation of burnup in the Oklo natural nuclear reactor from ruthenium isotopic composition. In: Journal of Radioanalytical and Nuclear Chemistry. Band 155, Nr. 2, 1. September 1991, S. 107–113, doi:10.1007/BF02165064.
- ↑ Fission Yield Graph. In: jaea.go.jp. Abgerufen am 20. Dezember 2022.
- ↑ a b c d K. Yoshihara: Technetium in the Environment. In: K. Yoshihara, T. Omori (Hrsg.): Technetium and Rhenium – Their Chemistry and Its Applications. (= Topics in Current Chemistry. Vol. 176). Springer-Verlag, Berlin/ Heidelberg 1996, ISBN 3-540-59469-8.
- ↑ Keiko Tagami: Technetium-99 Behaviour in the Terrestrial Environment – Field Observations and Radiotracer Experiments. ( vom 16. Juli 2011 im Internet Archive) In: Journal of Nuclear and Radiochemical Sciences. 4, 2003, S. A1–A8.
- ↑ John D. Harrison, Alan Phipps: Gut transfer and doses from environmental technetium. In: J. Radiol. Prot. 21, 2001, S. 9–11; doi:10.1088/0952-4746/21/1/004.
- ↑ Transmutation of Technetium in the Petten High Flux Reactor: A Comparison of Measurements and Calculations, 1998.
- ↑ Vladimir Peretroukhine, Viacheslav Radchenko, Andrei Kozar', Valeriy Tarasov, Iury Toporov: Technetium transmutation and production of artificial stable ruthenium. In: Comptes Rendus Chimie. Band 7, Nr. 12, 1. Dezember 2004, S. 1215–1218, doi:10.1016/j.crci.2004.05.002.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Atomic, Molecular, and Optical Physics, S. 10-75.
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica B. 30, 1974, S. 193–204; doi:10.1107/S0567740874002469.
- ↑ Vitaly V. Kuznetsov, Frederic Poineau, Konstantin E. German, Elena A. Filatova: Pivotal role of 99Tc NMR spectroscopy in solid-state and molecular chemistry. In: Communications Chemistry. Band 7, Nr. 1, 11. November 2024, S. 1–13, doi:10.1038/s42004-024-01349-2, PMC 11555319 (freier Volltext).
- ↑ V. P. Tarasov, Yu. B. Muravlev, K. E. German & N. N. Popova: 99-Tc NMR of Supported Technetium Nanoparticles. In: Zeitschrift: Doklady Physical Chemistry. Band 377, März 2001, S. 71–76, doi:10.1023/A:1018872000032.
- ↑ V. P. Tarasov, Yu. B. Muravlev and K.E. Guerman: Knight shift, spin-lattice relaxation and electric field gradient in technetium metal. In: Journal of Physics: Condensed Matter. Band 13, Nr. 48, 16. November 2001, S. 11041, doi:10.1088/0953-8984/13/48/328.
- ↑ a b c S. J. Rimshaw: The Encyclopedia of the Chemical Elements. Hrsg.: Cifford A. Hampel. Reinhold Book Corporation, New York 1968, S. 689–693.
- ↑ S. H. Autler: Technetium as a Material for AC Superconductivity Applications. In: Proceedings of the 1968 Summer Study on Superconducting Devices and Accelerators. abgerufen am 5. Mai 2009 (PDF)
- ↑ K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, S. 96.
- ↑ K. E. German, V. F. Peretrukhin, K. N. Gedgovd, M. S. Grigoriev, A. V. Tarasov, Yu V. Plekhanov, A. G. Maslennikov, G. S. Bulatov, V. P. Tarasov, M. Lecomte: Tc Carbide and New Orthorhombic Tc Metal Phase. In: Journal of Nuclear and Radiochemical Sciences. Band 6, Nr. 3, 2005, S. 211–214, doi:10.14494/jnrs2000.6.3_211.
- ↑ Nuclear Energy Agency (1999): Chemical Thermodynamics of Technetium. (PDF; 5,3 MB)
- ↑ K. E. German, V. F. Peretrukhin, K. N. Gedgovd, M. S. Grigoriev, A. V. Tarasov, Yu V. Plekhanov, A. G. Maslennikov, G. S. Bulatov, V. P. Tarasov, M. Lecomte: Tc Carbide and New Orthorhombic Tc Metal Phase. In: Journal of Nuclear and Radiochemical Sciences. Band 6, Nr. 3, 2005, S. 211–214, doi:10.14494/jnrs2000.6.3_211 (jst.go.jp [abgerufen am 2. November 2023]).
- ↑ Vitaly V. Kuznetsov, Konstantin E. German, Olga A. Nagovitsyna, Elena A. Filatova, Mikhail A. Volkov, Anastasiia V. Sitanskaia, Tatiana V. Pshenichkina: Route to Stabilization of Nanotechnetium in an Amorphous Carbon Matrix: Preparative Methods, XAFS Evidence, and Electrochemical Studies. In: Inorganic Chemistry. 31. Oktober 2023, doi:10.1021/acs.inorgchem.3c03001.
- ↑ Qinggao Wang, Konstantin E. German, Artem R. Oganov, Huafeng Dong, Oleg D. Feya, Ya V. Zubavichus, V. Yu Murzin: Explaining stability of transition metal carbides – and why TcC does not exist. In: RSC Advances. Band 6, Nr. 20, 8. Februar 2016, S. 16197–16202, doi:10.1039/C5RA24656C.
- ↑ a b Technetium, Nuclides / Isotopes. Abgerufen am 5. Mai 2009.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Nuclear and Particle Physics, S. 11-106.
- ↑ K. Schwochau: Technetium radiopharmaceuticals: Fundamentals, synthesis, structure and development. In: Angewandte Chemie International Edition. 33 (22), 1994, S. 2258–2267; doi:10.1002/anie.199422581.
- ↑ K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, S. 414.
- ↑ a b Joseph F. Smith: Technetium heart scan. ( vom 8. September 2002 im Internet Archive)
- ↑ Jonathan R. Dilworth, Suzanne J. Parrott: The biochemical chemistry of technetium and rhenium. In: Chemical Society Reviews. 27, 1998, S. 43–55; doi:10.1039/a827043z.
- ↑ Engpässe in der Tumormedizin. Krebsärzten gehen die Diagnosemittel aus. In: Der Spiegel. 11. Mai 2010.
- ↑ Norbert Lossau: Krebs-Diagnostik: Es droht ein Mangel an Technetium-99. In: welt.de. 2. August 2017, abgerufen am 7. Oktober 2018.
- ↑ EPA: 402-b-04-001b-14-final. (PDF; 1,6 MB) Marlap, Juli 2004, abgerufen am 4. August 2008.
- ↑ K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, S. 91.
- ↑ K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, S. 127–136.
- ↑ K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, S. 104.
- ↑ Di Zhou, Dmitrii V. Semenok, Mikhail A. Volkov, Ivan A. Troyan, Alexey Yu. Seregin, Ilya V. Chepkasov, Denis A. Sannikov, Pavlos G. Lagoudakis, Artem R. Oganov, Konstantin E. German: Synthesis of technetium hydride $\mathrm{Tc}{\mathrm{H}}_{1.3}$ at 27 GPa. In: Physical Review B. Band 107, Nr. 6, 6. Februar 2023, S. 064102, doi:10.1103/PhysRevB.107.064102 (aps.org [abgerufen am 13. Oktober 2023]).
- ↑ B. Krebs: Technetium(VII)-oxid: Ein Übergangsmetalloxid mit Molekülstruktur im festen Zustand. In: Angewandte Chemie. 81 (9), 1969, S. 328–329; doi:10.1002/ange.19690810905.
- ↑ A. Y. Herrell, R. H. Busey, K. H. Gayer, K. Schwochau, S. Gutzeit: Technetium(VII) Oxide. In: Inorganic Syntheses. Vol. XVII, 1977, ISBN 0-07-044327-0, S. 155–158; doi:10.1002/9780470132487.ch41.
- ↑ K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, S. 108.
- ↑ Konstantin E. German, Alexander M. Fedoseev, Mikhail S. Grigoriev, Gayane A. Kirakosyan, Thomas Dumas: A 70‐Year‐Old Mystery in Technetium Chemistry Explained by the New Technetium Polyoxometalate [H 7 O 3 ] 4 [Tc 20 O 68 ] ⋅ 4H 2 O. In: Chemistry – A European Journal. Band 27, Nr. 54, 24. September 2021, S. 13624–13631, doi:10.1002/chem.202102035.
- ↑ Tc(V)-Tc(VII)-Polyoxometallat, auf chemistry-europe.onlinelibrary.wiley.com
- ↑ Markus Zegke; DennisGrödler; Maximilian Roca Jungfer; Alexander Haseloer; Meike Kreuter; Jörg M. Neudörfl; ThomasSittel; Christopher M. James; Jörg Rothe; Marcus Altmaier; Axel Klein(2022-01-17). "Ammonium Pertechnetate in Mixtures of Trifluoromethanesulfonic Acid and Trifluoromethanesulfonic Anhydride". Angewandte Chemie International Edition. 61 (3). doi:10.1002/anie.202113777.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1623.
- ↑ a b Polynuclear technetium halide clusters, auf researchgate.net
- ↑ K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, S. 112–113.
- ↑ K. E. German, S. V. Kryutchkov: Polynuclear Technetium Halide Clusters. In: Russian Journal of Inorganic Chemistry. 47 (4), 2002, S. 578–583.
- ↑ J. C. Hileman, D. K. Huggins, H. D. Kaesz: Technetium carbonyl. In: Journal of the American Chemical Society. 83 (13), 1961, S. 2953–2954; doi:10.1021/ja01474a038.
- ↑ Marcia F. Bailey, Lawrence F. Dahl: The Crystal Structure of Ditechnetium Decacarbonyl. In: Inorganic Chemistry. 4 (8), 1965, S. 1140–1145; doi:10.1021/ic50030a011.
- ↑ D. Wallach: Unit cell and space group of technetium carbonyl, Tc2(CO)10. In: Acta Crystallographica. 15, 1962, S. 1058–1058; doi:10.1107/S0365110X62002789.
- ↑ K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, S. 286, 328.
- ↑ Silva Jurisson, E. O. Schlemper, D. E. Troutner, L. R. Canning, D. P. Nowotnik, R. D. Neirinckx: Synthesis, characterization, and x-ray structural determinations of technetium(V)-oxo-tetradentate amine oxime complexes. In: Inorganic Chemistry. 25 (4), 1986, S. 543–549; doi:10.1021/ic00224a031.
- ↑ K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, S. 40.


![{\displaystyle \mathrm {^{99}_{39}Y\ {\xrightarrow[{1{,}47\,s}]{\beta ^{-}}}\ _{40}^{99}Zr\ {\xrightarrow[{2{,}1\,s}]{\beta ^{-}}}\ _{41}^{99}Nb\ {\xrightarrow[{15{,}0\,s}]{\beta ^{-}}}\ _{42}^{99}Mo\ {\xrightarrow[{65{,}94\,h}]{\beta ^{-}}}\ _{43}^{99}Tc\ {\xrightarrow[{211100\,a}]{\beta ^{-}}}\ _{44}^{99}Ru} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/70963d83d65b0763fa88e9b7f7880a3fbe0762c3)








