Stoffeigenschaft


Eine Stoffeigenschaft ist charakteristisch und spezifisch für einen Reinstoff oder ein Stoffgemisch. Unter Normalbedingungen ist jeder Reinstoff durch eine einzigartige Kombination von Eigenschaften identifizierbar. In Stoffgemischen überlagern sich hingegen die Eigenschaften der Komponenten oder bilden gänzlich neue aus. Die Eigenschaften können mit den Sinnen wahrgenommen werden (z. B. Farbe, Geruch) oder sind durch Messungen als Größe quantifizierbar (z. B. die Dichte eines Stoffes).
Eine stoffeigene Größe ist die Kombination aus Zahlenwert und Maßeinheit. Intensive Zustandsgrößen (molare und spezifische) werden auch als Stoffkonstanten oder Materialkonstanten bezeichnet. Extensive Größen sind hingegen die mengen- bzw. massebezogenen Gegenstücke.
Hingegen bezeichnen Werkstoffe im Allgemeinen Stoffgemische, bei denen der Syntheseweg oder das Fertigungsverfahren einen entscheidenden Einfluss auf die Stoffeigenschaften haben.
Physikalische Stoffeigenschaften
[Bearbeiten | Quelltext bearbeiten]
Physikalische Stoffeigenschaften sind experimentell bestimmbar. Quantifizierbar sind sie durch Messungen der zugrunde liegenden physikalischen Größen. Bei der Messung wird eine physikalische Eigenschaft des Messobjekts, im Unterschied zu den chemischen Eigenschaften, nicht verändert.[1]
Zu den Stoffeigenschaften aus den physikalischen Teilgebieten gehören:[2]
| Thermodynamik | Mechanik | Elektrodynamik | Optik und Akustik |
|---|---|---|---|
|
|
Chemische Stoffeigenschaften
[Bearbeiten | Quelltext bearbeiten]Chemische Stoffeigenschaften sind experimentell bestimmbar. Quantifizierbar sind sie durch Messungen der zugrunde liegenden chemischen Größen bei einer chemischen Reaktion des entsprechenden Stoffes, z. B. mit einem anderen, Zersetzung oder Umlagerung. Deshalb muss bei der Bestimmung von chemischen Stoffeigenschaften das Messobjekt(Stoff) verändert werden, im Unterschied zur Untersuchung seiner physikalischen Eigenschaften.[3]

Zu den chemischen Stoffeigenschaften gehören:
- Antimikrobielle Wirkung
- Bildungsenthalpie, Verbrennungsenthalpie, gibbssche freie Bildungsenthalpie
- Brennbarkeit
- Elektronegativität (bei Elementen)
- Flammenfärbung
- Korrosionsbeständigkeit (gegenüber Wasser, feuchter Luft, Elektrolytlösungen)
- Löslichkeit
- Reaktivität gegenüber verschiedenen anderen Stoffen (z. B. gegenüber Sauerstoff: Brennbarkeit, aber auch gegenüber wichtigen Reagenzien wie Wasser, Säuren, Basen, Metallen, Salzlösungen, Chlorgas, Schwefel, Nachweisreagenzien usw.)
- Standardpotential (elektrochemische Spannungsreihe)
- Säurekonstante KS bzw. Basenkonstante KB
- Gefahrstoffeigenschaften
Physiologische Stoffeigenschaften
[Bearbeiten | Quelltext bearbeiten]Unter physiologischen Eigenschaften versteht man physikalische und chemische Stoffeigenschaften unter dem Aspekt der Wahrnehmbarkeit oder der Auswirkungen auf die Umgebung.
Zu den physiologischen Stoffeigenschaften gehören:
- Geruch
- Geschmack
- Metabolismus
- Resorbierbarkeit
- Toxizität, Ökotoxizität (Umweltschädlichkeit) und ähnliche biologische Wirkungen
Nutzung in Chemie und Technik
[Bearbeiten | Quelltext bearbeiten]Werkstoffe
[Bearbeiten | Quelltext bearbeiten]Ein Werkstoff ist in der Regel ein Stoffgemisch, in dem die einzelnen Stoffeigenschaften kombiniert werden oder gänzlich neuen Werkstoffeigenschaften und Werkstoffkennwerten resultieren. Beispielsweise ist Stahl viel härter als Eisen und für Werkzeuge vielerlei Art geeignet. Glas wird durch Flussmittel besser schmelzbar und chemisch stabil, was für Gefäße und transparente Fenster usw. von Bedeutung ist. Diese Werkstoffeigenschaften sind stark von der Synthese und Fertigungsverfahren abhängig und gehören zu dem zentralen Forschungsgebiet der Werkstoffkunde.[4]
Auftrennung von Stoffgemischen
[Bearbeiten | Quelltext bearbeiten]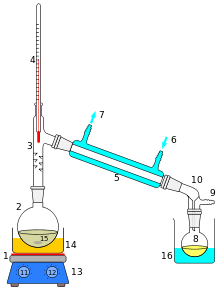
1: Heizquelle
2: Destillierkolben
3: Destillieraufsatz
4: Thermometer
5: Liebig-Kühler
6: Kühlwassereingang
7: Kühlwasserausgang
8: Rundkolben für das Destillat
9: Druckausgleich
10: Vorstoß
11: Regler Badtemperatur
12: Regler Drehzahl Magnetrührers
13: Magnetrührgerät, Heizplatte
14: Heizbad (Wasserbad, Ölbad)
15: Magnetrührstab, Siedesteine
16: Kühlbad, evtl. Eisbad
Unter Nutzung unterschiedlicher Stoffeigenschaften lassen sich Stoffgemische in ihre Einzelkomponenten auftrennen. Technisch einfach ist die Trennung durch unterschiedliche Aggregatzustände einzelner Komponenten in Festkörpern, Flüssigkeiten und Gasen (Stofftrennverfahren, Separationstechnik):
- Bei einer Destillation wird z. B. ein Gemisch mehrerer Flüssigkeiten dadurch aufgetrennt, dass man das Gemisch über die Siedetemperatur einer Komponente hinaus erwärmt. Diese siedet dann, sodass der schwerer flüchtige Anteil zurückbleibt. Der Dampf wird im Kühler unter die Siede-/Kondensationstemperatur der leichter flüchtigen Komponente abgekühlt. Diese wird dann als Destillat bzw. Kondensat in der Vorlage gesammelt.
- Bei der fraktionierenden Kristallisation löst man ein Gemisch von Feststoffen in einem geeigneten Lösungsmittel und stellt durch Abdampfen oder Verdunsten eine übersättigte Lösung her, aus der eine Feststoff des Gemischs bevorzugt auskristallisiert und durch Filtration isoliert werden kann.
- Ein Eisenpulver/Sand-Gemisch kann hingegen aufgetrennt werden, indem man den Magnetismus des Eisens nutzt (eine physikalische Stoffeigenschaft) – oder aber das Gemisch in Säure löst, welche das Eisen anätzt, den Sand aber ungelöst und somit filtrierbar zurücklässt (chemische Eigenschaft).
Reinheitskontrolle
[Bearbeiten | Quelltext bearbeiten]Um ein im Arzneimittel- oder Chemielabor neu hergestelltes Präparat, einen chemischen Stoff näher zu charakterisieren und seine Reinheit und Qualität zu kontrollieren, untersucht man dessen Eigenschaften. Oft werden zur Qualitätskontrolle chemischer und pharmazeutischer Produkte hoch entwickelte Analysetechniken eingesetzt, so z. B. die NMR-Spektroskopie.
Identifikation von Stoffen
[Bearbeiten | Quelltext bearbeiten]Zur Identifikation von organischen Stoffen in der industriellen Wareneingangskontrolle wird oft das Infrarotspektrum (IR-Spektrum) aufgenommen und mit dem IR-Referenzspektrum eines Standards verglichen. Wenn die IR-Spektren – vor allem in Fingerprint-Bereich[5] – identisch sind, ist das ein sehr guter Identitätsbeweis.
Klassifikation von Stoffen
[Bearbeiten | Quelltext bearbeiten]In der Analytik werden Stoffe in einer unbekannten Probe anhand ihrer Stoffeigenschaften identifiziert und klassifiziert. Bestimmte Eigenschaften charakterisieren auch bestimmte Stoffgruppen wie z. B. die Stoffklassen der Metalle, Salze, Edelgase, Halogene oder organische Stoffe:
- Alle Metalle leiten elektrischen Strom und Wärme gut, sind gut verformbar, haben im reinen Zustand Oberflächenglanz (erscheinen aber im feinverteilten Zustand schwarz; Untergruppen: Alkalimetalle, Edelmetalle, Buntmetalle u. a.).
- Nichtmetalle (molekulare Stoffe wie z. B. Halogene und Kohlenwasserstoffe) leiten den elektrischen Strom kaum (Isolatoren), sind im festen Zustand zumeist spröde und weisen niedrige Siedepunkte auf (sofern sie nicht diamant- oder kunststoffartig sind: Makromolekulare Stoffe haben oft hohe Schmelz- und Siedetemperaturen, zersetzen sich aber meist schon bei relativ niedrigen Temperaturen, Beispiele: Kunststoffe, Proteine, Polysaccharide, DNA).
- Salzartige Stoffe haben relativ hohe Schmelz- und Siedetemperaturen, leiten als Schmelzen oder Lösungen den elektrischen Strom und sind kristallin sowie spröde.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ P. W. Atkins, J. A. Beran: Chemie – einfach alles. VCH, Weinheim 1996.
- ↑ Formelsammlung Formeln, Tabellen, Daten ; Mathematik, Physik, Astronomie, Chemie, Biologie, Informatik. 1. Auflage. Berlin, ISBN 978-3-89818-700-8.
- ↑ Physikalische und chemische Eigenschaften, auf aten.didaktikchemie.uni-bayreuth.de
- ↑ Günter Gottstein: Materialwissenschaft und Werkstofftechnik (= Springer-Lehrbuch). Springer Berlin Heidelberg, Berlin/Heidelberg 2014, ISBN 978-3-642-36602-4, doi:10.1007/978-3-642-36603-1.
- ↑ Siegfried Hauptmann: Organische Chemie. 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 43–45.