Mesitylensulfochlorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Mesitylensulfochlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C9H11ClO2S | ||||||||||||||||||
| Kurzbeschreibung |
hellgrauer[1] bzw. cremefarbener bis weißer kristalliner Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 218,72 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Mesitylensulfochlorid ist eine chemische Verbindung aus der Gruppe der Sulfonsäurechloride. Es ist ein räumlich anspruchsvolles aromatisches Sulfonsäurechlorid, das wegen seiner Reaktivität als Ausgangsverbindung von Mesitylensulfonylverbindungen dient, die besonders als biochemische Reagentien Verwendung finden. Fachsprachlich wird Mesitylensulfochlorid auch als MSCl oder Mts-Cl abgekürzt.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Darstellung von Mesitylsulfochlorid aus Mesitylen, Sulfurylchlorid und Aluminiumchlorid wurde bereits 1893 beschrieben.[5]

Nach einer Laborvorschrift[6] wird Mesitylensulfochlorid erhalten durch Zugabe von Chlorsulfonsäure zu Mesitylen bei Temperaturen zwischen −15 und 60 °C und anschließendem Ausfällen des entstandenen Sulfochlorids durch Eingießen in Eiswasser und Extraktion mit Dichlormethan. Das in einer Rohausbeute von 80 % anfallende Mesitylensulfochlorid erstarrt zu weißlichen Kristallen.

Sehr hohe Ausbeuten (94 %) werden nach einer neueren Methode bei der Umsetzung des Natriumsalzes der Mesitylensulfonsäure mit Cyanurchlorid in Gegenwart des Phasentransferkatalysators 18-Krone-6 in Aceton erzielt.[7]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Mesitylensulfochlorid ist ein weißer bis creme-farbener hygroskopischer Feststoff mit unangenehm stechendem Geruch, der sich unter Zersetzung in Wasser löst. Die dabei entstehende Mesitylensulfonsäure wirkt stark ätzend und korrosiv. In einer Vielzahl von trockenen organischen Lösungsmitteln ist die Substanz gut löslich. Zur Reinigung kann Mts-Cl aus Hexan oder Pentan umkristallisiert werden.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Sulfonamidbildung
[Bearbeiten | Quelltext bearbeiten]Mesitylsulfochlorid findet zur Einführung der Mesitylsulfonyl-(Mst)-Schutzgruppe für Aminosäuren und Peptide breitere Anwendung.[8] Durch Umsetzung mit Mesitylensulfochlorid können Guanidinogruppen, wie z. B. in (an der α-Aminogruppe mit der p-Methoxybenzyloxycarbonyl-Gruppe geschütztem) L-Arginin mit der Mst-Schutzgruppe blockiert werden.[9]
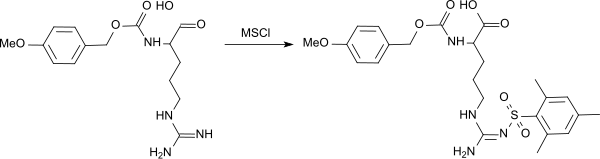
Die Mesitylensulfonyl-Schutzgruppe kann mittels Methansulfonsäure (MSA), Trifluormethansulfonsäure (TFMSA)/Fluorwasserstoff[10] und mit TFMSA/Trifluoressigsäure (TFA)/Thioanisol[9] quantitativ abgespalten werden.
In ähnlicher Weise lässt sich die Indol-Gruppe der Aminosäure L-Tryptophan mit Mesitylensulfochlorid unter Bildung des entsprechenden Sulfonamids schützen und mit TFMSA/TFA oder Methansulfonsäure entschützen.[11]
Sulfonatbildung
[Bearbeiten | Quelltext bearbeiten]In Gegenwart von Pyridin können primäre und sekundäre Hydroxygruppen, z. B. in Mono- und Oligosacchariden durch Umsetzung mit Mesitylensulfochlorid blockiert werden.[12]

Dabei werden mit Methyl-α-D-Glucopyranosid Ausbeuten von 98 % des in 2,6-Stellung Mst-disubstituierten Methylglucosids erhalten.
Kondensationsreaktionen
[Bearbeiten | Quelltext bearbeiten]Mesitylensulfochlorid wurde auch zur Aktivierung von Carbonsäuren bei der Herstellung von Estern eingesetzt, wie z. B. der Verknüpfung der selektiv geschützten so genannten Nonactinsäure zum Dimeren
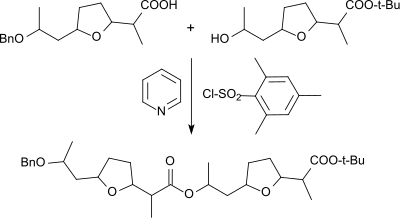
und anschließend zum Tetrameren, aus dem durch Ringschluss in Gegenwart von Silber-Ionen das Makrotetrolid-Antibiotikum Nonactin entsteht,[13] das kronenetherartige Eigenschaften aufweist.
Nucleotidsynthesen
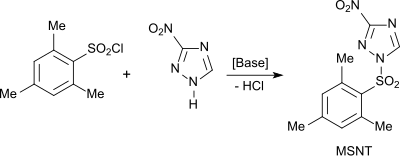
[Bearbeiten | Quelltext bearbeiten]Mesitylensulfonylchlorid hat trotz längerer Reaktionszeiten im Vergleich zu komplizierter aufgebauten aromatischen Sulfochloriden, wie z. B. 1-Mesitylensulfonyl-3-nitro-triazol (MSNT) oder 1-(Mesitylsulfonyloxy)-4,6-dinitrobenztriazol, zusammen mit nucleophilen Katalysatoren, wie z. B. 3-Nitro-1H-1,2,4-triazol oder 1-Hydroxy-4,6-dinitrobenztriazol, Vorteile bei der Aktivierung von Phosphodiestern zur Umsetzung mit Nucleosiden nach dem Phosphotriester-Verfahren zum Aufbau von Oligonucleotiden.[14]

Weitere Verwendungen
[Bearbeiten | Quelltext bearbeiten]Die Reaktion von Mesitylsulfonylchlorid mit stickstoffhaltigen Heteroaromaten eignet sich zur Herstellung von Diarylsulfonamiden, die als spezifische Antagonisten für das Protein EPAC 2 (exchange protein directly activated by cAMP), das als cAMP-Mediator unterschiedliche biologische Funktionen steuert.

Das Sulfonamid mit 2,4-Dimethylpyrrol erwies sich als 133-mal wirksamer als cAMP.[15]
Aus Mesitylensulfonylchlorid und 3-Nitro-1H-1,2,4-triazol wird das Kondensationsmittel 1-(Mesityl-2-sulfonyl)-3-nitro-1H-1,2,4-triazol (MSNT) erhalten,[16] das als Aktivierungsagens für Nucleotidsynthesen Verwendung findet.[4]
Anstelle von Hydroxylamin-O-sulfonsäure wird häufig auch das wirksamere (aber erheblich teurere) O-Mesitylensulfonylhydroxylamin (MSH) für z. B. Aminierungsreaktionen eingesetzt.[17]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Mesitylen-2-sulfochlorid bei Sigma-Aldrich, abgerufen am 23. Oktober 2021 (PDF).
- ↑ a b c d Datenblatt Mesitylene-2-sulfonyl chloride bei Alfa Aesar, abgerufen am 21. September 2015 (Seite nicht mehr abrufbar).
- ↑ a b V. Vaillancourt, M.M. Cudahy, D. Carbery: Mesitylenesulfonyl Chloride. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2008, doi:10.1002/47084289X.rm049.pub2.
- ↑ a b C.B. Reese, Z. Pei-Zhuo: Phosphotriester approach to the synthesis of oligonucleotides: a reappraisal. In: J. Chem. Soc., Perkin Trans. 1. 1993, S. 2291–2301, doi:10.1039/P19930002291.
- ↑ A. Töhl, O. Eberhard: Ueber die Einwirkung des Sulfurylchlorids auf aromatische Kohlenwasserstoffe. In: Ber. Dtsch. Chem. Ges. Band 26, 1893, S. 2940–2945, doi:10.1002/cber.189302603118.
- ↑ J.R. Reid, R.F. Dufresne, J.J. Chapman: Benzenesulfonic acid, 2,4,6-trimethyl-, hydrazide In: Organic Syntheses. 74, 1997, S. 217, doi:10.15227/orgsyn.074.0217; Coll. Vol. 9, 1998, S. 281 (PDF).
- ↑ G. Blotny: A new, mild preparation of sulfonyl chlorides. In: Tetrahedron Lett. Band 44, Nr. 7, 2003, S. 1499–1501, doi:10.1016/S0040-4039(02)02853-8.
- ↑ M. Bodanszky, A. Bodanszky: The Practice of Peptide Synthesis, 2nd. Ed. Springer, 1994, doi:10.1007/978-3-642-85055-4.
- ↑ a b H. Yajima, M. Takeyama, J. Kanaki, O. Nishimura, M. Fujino: Studies on Peptides. LXXX. NG-Mesitylene-2-sulfonylarginine. In: Chem. Pharm. Bull. Band 26, Nr. 12, 1978, S. 3752–3757, doi:10.1248/cpb.26.3752., pdf
- ↑ H. Yajima, M. Takeyama, J. Kanaki, K. Mitani: The mesitylene-2-sulphonyl group, an acidolytically removable NG-protecting group for arginine. In: J. Chem. Soc., Chem. Commun. 1978, S. 482–483, doi:10.1039/C39780000482.
- ↑ N. Fuji, S. Futaki, K. Yasumura, H. Yajima: Studies on Peptides. CXXI. NIn-Mesitylenesulfonyl-tryptophan, a New Derivative for Peptide Synthesis. In: Chem. Pharm. Bull. Band 32, Nr. 7, 1984, S. 2660–2665, doi:10.1248/cpb.32.2660., pdf
- ↑ S.E. Creasey, R.D. Guthrie: Mesitylenesulphonyl chloride: a selective sulphonating reagent for carbohydrates. In: J. Chem. Soc., Perkin Trans. 1. 1974, S. 1373–1378, doi:10.1039/P19740001373.
- ↑ H. Gerlach, K. Oertle, A. Thalmann, S. Servi: Synthese des Nonactins. In: Helv. Chim. Acta. Band 58, Nr. 7, 1975, S. 2036–2043, doi:10.1002/hlca.19750580718.
- ↑ C.B. Reese: The chemical synthesis of oligo- and poly-nucleotides by the phosphotriester approach. In: Tetrahedron. Band 34, Nr. 21, 1978, S. 3143–3179, doi:10.1016/0040-4020(78)87013-6.
- ↑ H. Chen, T. Tsalkova, O.G. Chepurny, F.C. Mei, G.G. Holz, X. Cheng, J. Zhou: Identification and Characterization of Small Molecules as Potent and Specific EPAC2 Antagonists. In: J. Med. Chem. Band 56, Nr. 3, 2013, S. 952–962, doi:10.1021/jm3014162.
- ↑ R. Petersen, J.F. Jensen, T.E. Nielsen: An Improved Protocol for the Synthesis of 1-(Mesitylenesulfonyl)-3-nitro-1,2,4-triazole (MSNT). In: Org. Prep. Proc. Int. Band 46, Nr. 3, 2014, S. 267–271, doi:10.1080/00304948.2014.903145.
- ↑ J. Mendolia et al.: Preparation, Use, and Safety of O-Mesitylenesulfonylhydroxylamine. In: Org. Process Res. Dev. Band 13, Nr. 2, 2009, S. 263–267, doi:10.1021/op800264p.
