Metaldehyd
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Strukturformel des Tetramers von Acetaldehyd ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Metaldehyd | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H16O4 | |||||||||||||||
| Kurzbeschreibung |
farbloser, geschmackloser, leichtentzündlicher Feststoff mit schwachem charakteristischem Eigengeruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 176,21 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,27 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
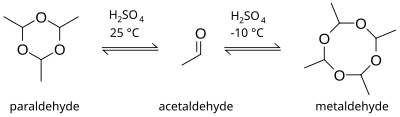
Metaldehyd ist ein cyclisches Acetal. Er ist das cyclische Tetramer des Acetaldehyds. Das Trimer wird Paraldehyd genannt. Unter der Bezeichnung Metaldehyd wird auch polymeres Acetaldehyd (CH3CHO)n vertrieben.[8]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Metaldehyd entsteht durch Cyclisierung von vier Molekülen Acetaldehyd in Gegenwart von Schwefelsäure bei niedrigen Temperaturen. Die Produktbildung der Cyclisierungsreaktion ist temperaturabhängig. Bei Raumtemperatur ist die Bildung des Trimers Paraldehyd bevorzugt. Bei niedrigeren Temperaturen um −10 °C entsteht eher der tetramere Metaldehyd.[9]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Metaldehyd ist ein farbloser, geschmackloser, leichtentzündlicher Feststoff mit schwachem charakteristischem Eigengeruch,[1] dessen Schmelzpunkt bei 45,5 °C liegt.[3] Die in der Literatur[2][8] angegebenen Schmelz- und Sublimationstemperaturen zwischen 100 °C und 250 °C beziehen sich auf polymeren Acetaldehyd und resultieren eher aus Depolymerisationsprozessen.
Wie bei Paraldehyd können auch für die Molekülstruktur von Metaldehyd mehrere Stereoisomere formuliert werden. Die Methylgruppen können jeweils axial oder äquatorial am Ring sein.
Der Heizwert beträgt 3370 kJ/mol entsprechend 19,1 MJ/kg.[10]
Metaldehyd kristallisiert in der Raumgruppe I4 (Raumgruppen-Nr. 79).[11]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Metaldehyd ist beispielsweise in Schneckenkorn enthalten.[12] Er ist ein Molluskizid und wird zusammen mit Ködermaterial (vorzugsweise Kleie) gegen Nacktschnecken, besonders Ackerschnecken eingesetzt. Eine gebräuchliche Anwendung sind Körner mit 4–6 % der Verbindung. Metaldehyd wirkt über Austrocknung der Schnecken. Er wird auch als Trockenbrennstoff bei Spielwaren, z. B. Spiel-Dampfmaschinen, verwendet.[5]
Metaldehyd ist in der Europäischen Union als Pflanzenschutzmittel allgemein zugelassen. Entsprechend sind in Deutschland, Österreich und der Schweiz Metaldehyd-haltige Präparate erhältlich.[13] Beim Herstellen oder Behandeln von kosmetischen Mitteln darf es laut Verordnung (EG) Nr. 1223/2009, Anhang II nicht verwendet werden.[5]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Esbit
- Trockenspiritus (Hexamethylentetramin; Esbit besteht daraus)
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Poisons Information Monograph (PIM) für Metaldehyde
- Institut für Veterinärpharmakologie und -toxikologie: Metaldehyd
- Linus Pauling, D. C. Carpenter: The Crystal Structure of Metaldehyde. In: Journal of the American Chemical Society. Band 58, Nr. 7, 1936, S. 1274–1278, doi:10.1021/ja01298a054.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt Metaldehyd bei Alfa Aesar, abgerufen am 14. April 2010 (Seite nicht mehr abrufbar).
- ↑ a b c d e f Eintrag zu 2,4,6,8-Tetramethyl-1,3,5,7-tetraoxacycloctan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ a b E. C. Craven, H. Jowitt, W. R. Ward: Polymeric forms of acetaldehyde. In: Journal of Applied Chemistry. 12, 1962, S. 526–535, doi:10.1002/jctb.5010121202.
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics. 85. Auflage, 2005, CRC Press, Kap. 3, S. 356.
- ↑ a b c Eintrag zu Metaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. Dezember 2021.
- ↑ Eintrag zu 2,4,6,8-tetramethyl-1,3,5,7-tetraoxacyclooctane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Januar 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ WHO/FAO Data Sheet on Pesticides (PDS) für Metaldehyde, abgerufen am 9. Dezember 2014.
- ↑ a b Aldrich-Katalog Handbuch Feinchemikalien und Laborgeräte 2009/2010.
- ↑ H.P. Latscha; U. Kazmaier; H.A. Klein: Chemie für Biologen, Springer Verlag 2005, S. 515, ISBN 3-540-21161-6.
- ↑ Eintrag zu Metaldehyde in der Hazardous Substances Data Bank (via PubChem), abgerufen am 10. Februar 2019.
- ↑ S. A. Barnett, A. T. Hulme, D. A. Tocher: A low-temperature redetermination of metaldehyde. In: Acta Crystallographica Section E: Structure Reports Online. Band 61, Nr. 4, 2005, S. o857–o859, doi:10.1107/S1600536805006306 (iucr.org).
- ↑ Hans-Hasso Frey: Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin: 131 Tabellen. Georg Thieme Verlag, 2007, ISBN 978-3-8304-1070-6, S. 553 (books.google.com).
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Metaldehyde in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs (Eingabe von „Metaldehyd“ im Feld „Wirkstoff“) und Deutschlands, abgerufen am 8. Juni 2022.


